缺糖缺氧/再灌注对星形胶质细胞外泌体miRNAs表达的影响*
时间:2023-03-23 10:15:07 来源:千叶帆 本文已影响人
韩韦华,黄庭睿,文田甜,沈 耀
温州医科大学检验医学院(生命科学学院)/检验医学教育部重点实验室,浙江温州 325035
星形胶质细胞是脑组织内数量最多的一类细胞,其通过大量突起或递质的分泌与脑内其他细胞建立密切的信息联系,在正常生理及病理过程中扮演着重要角色[1]。外泌体是一种直径为40~100 nm的囊性小泡,是已发现的众多细胞外微粒体的一种,可由机体多种细胞分泌[2]。外泌体中具有相当数量的微小RNA(miRNAs)、信使RNA(mRNA)、蛋白质,甚至还包括线粒体DNA,并通过依赖于膜表面信号分子,膜融合后的内容物释放,以及信号分子的胞外释放等途径在细胞间信息的传递中发挥重要作用[3]。外泌体在多种疾病中发挥着重要调节作用,如间充质基质细胞(MSCs)可通过分泌外泌体在心脑血管等疾病的治疗中发挥作用[4-5],而这种作用又受外泌体的来源细胞和靶细胞所处的环境和状态影响[6-7]。脑组织内的星形胶质细胞也可分泌外泌体,而且对星形胶质细胞做不同的处理就会刺激其释放出具有不同生物学作用的外泌体[8-9]。细胞分泌的miRNAs通过外泌体的运输可传送到另一个细胞,而miRNA通过靶向降解mRNA或抑制mRNA的翻译参与个体的发育、细胞分化、增殖、凋亡等生理调控过程[10-11]。目前,外泌体miRNAs调控作用成为细胞与细胞之间信息传递研究的热点。然而,星形胶质细胞源性外泌体miRNAs分泌水平在脑缺血过程中的变化及其在缺血损伤及修复中所发挥的作用尚不清楚。因此,本研究利用新一代高通量Illumina MiSeq测序技术对星形胶质细胞源性外泌体miRNAs进行生物信息学分析,探讨缺糖缺氧(OGD)和缺糖缺氧/再灌注(OGD/R)对星形胶质细胞外泌体miRNAs表达谱的影响。
1.1材料 新生24 h内SPF级的Sprague-Dawley(SD)大鼠由温州医科大学动物实验中心提供。胰酶细胞消化液、多聚-D-赖氨酸溶液、BCA蛋白浓度检测试剂盒和青霉素-链霉素溶液购自碧云天生物技术有限公司。高糖DMEM、无糖DMEM培养液及去外泌体血清购自Gibco公司。胎牛血清为Natocor公司产品。全反式维甲酸诱导(ATRA)购自生工生物工程(上海)股份有限公司。抗-Actin兔单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG(1∶1 000稀释使用)购自杭州戴格生物技术有限公司。抗-p-细胞外信号调节激酶(Erk)1、抗-p-Erk2和抗-Erk1、抗-Erk2兔单克隆抗体(1∶5 000稀释使用)购自Abcam公司。RNAiso Plus试剂盒购自宝生物工程(大连)有限公司。实时荧光定量聚合酶链反应(qPCR)检测试剂:HiScript ⅡQ RT SuperMix、ChamQ Universal SYBR qPCR Master Mix均购自诺唯赞生物科技有限公司。
1.2方法
1.2.1细胞培养 参考文献[12]的方法进行细胞培养。采用24 h内新生SD大鼠的大脑皮层,用手术刀片切碎,再用0.25%胰酶消化20 min。而后用玻璃滴管吹打细胞团块直到未见明显絮状组织后停止吹打而获得细胞悬液。将细胞种植于预先用多聚-D-赖氨酸溶液包被的密闭细胞培养瓶中。培养10 d左右,细胞长满整个瓶底,将其固定在37 ℃恒温摇床中,以250 r/min速率振荡摇晃16 h左右,以去除小胶质等杂细胞而使星形胶质细胞纯化。SH-SY5Y细胞(源于人神经母细胞瘤细胞)培养于DMEM培养液,待生长到60%~70%时去掉旧的培养基,用PBS洗涤细胞3次,而后培养于含1%胎牛血清(FBS)的DMEM培养基。在避光条件下,加入ATRA溶液,使其终浓度为15 μmol/L,处理4 d。
1.2.2细胞OGD/R模型的构建 待星形胶质细胞长满后,用PBS洗涤3次,加入无糖DMEM溶液,再将细胞置于缺氧罐内(95% N2、5%CO2,37 ℃)处理2/4 h(作为OGD 2/4 h组)。待OGD 2/4 h处理结束后去除无糖DMEM并换成正常含糖DMEM培养基,并置于37 ℃恒温CO2培养箱内培养,作为OGD 2 h/R 24 h或OGD 4 h/R 24 h组。
1.2.3星形胶质细胞外泌体提取 用去外泌体血清培养星形胶质细胞24 h后收集培养基上清液,然后用超速离心法收集外泌体。分别收集星形胶质细胞在不同条件下处理后的培养上清液。以400×g离心5 min后提高转速到3 000×g离心15 min。去除沉淀收集上清液,以10 000× g离心30 min后用0.22 μm注射滤器过滤,以120 000×g离心90 min。收集的沉淀用PBS重悬,继续以120 000×g离心90 min,弃净上层PBS重悬液后加入100 μL PBS后吹打沉淀,收集到预冷过的EP管内,-80 ℃保存。
1.2.4透射电镜法鉴定外泌体 样品固定在2.5%的戊二醛溶液内,置于4 ℃过夜;
倒掉固定液后用0.1 mol/L,pH值为7.0的磷酸盐缓冲液漂洗样品3次,每次15 min。再用1%的锇酸溶液固定样品1~2 h,后用磷酸盐缓冲液漂洗。设置乙醇溶液浓度梯度(包括30%、50%、70%、80%、90%和95%这6种浓度)对样品进行脱水处理,每种浓度处理15 min,再用100%的乙醇处理20 min;
最后过度到纯丙酮中处理20 min。用Spurr包埋剂与丙酮的混合液(体积比为1∶1)处理样品1 h;
用Spurr包埋剂与丙酮的混合液(体积比为3∶1)处理样品3 h;
纯包埋剂处理样品过夜;
将样品经过渗透处理后包埋置于70 ℃加热过夜,即得到包埋好的样品。利用莱卡EM UC7型超薄切片机将包埋样品切成70~90 nm的切片,柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液对切片各染色5~10 min,即可在日立H-7650型透射电镜中观察。
1.2.5外泌体流式细胞仪表面标记物检测 使用流式细胞术进行外泌体表面标记物CD81和CD63的检测。经超速离心法收集分离得到的星形胶质细胞源性外泌体沉淀,用100 μL已经过滤的PBS复匀外泌体。用不染色的外泌体作为阴性对照;
将收集到的外泌体分别进行CD63和CD81两组抗体染色,标记为CD63和CD81。按照仪器操作规程上机检测(由广州市锐博生物科技有限公司完成)。
1.2.6外泌体miRNA高通量测序 标本提取总RNA后,首先使用T4 RNA连接酶2将一个腺苷化单链DNA 3′接头和5′接头相继连接到small RNA上,其中3′端接头的5端为rAPP,3端有氨基保护,所以能够减少miRNA的自连。5′端接头被设计成可以捕获带有5′磷酸基团的small RNA。带有5′与3′链接接头的small RNA序列,通过与3端互补的反转录引物进行反转录反应,最后对反转录产生的cDNA序列进行PCR扩增。最后,对140~160 bp长度范围的PCR产物进行聚丙烯酰胺凝胶电泳后进行胶回收,从而完成整个文库的制备工作,对构建好的文库使用Illumina Hiseq2500进行测序,测序读长为单端1×50 bp(由杭州联川生物技术股份有限公司完成)。
1.2.7qPCR验证 检测细胞内及外泌体内let-7家族3种miRNAs。使用RNAiso Plus试剂提取细胞内及外泌体内总RNA。使用miRNA 1st Strand cDNA Synthesis试剂盒(茎-环法)从1 μg总RNA合成cDNA,然后采用miRNA Universal SYBR qPCR Master Mix进行qPCR,以U6作内参对照。相对miRNA表达水平采用2-ΔΔCt方法进行计算。引物序列如下,let-7 miRNAs反转录引物:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGAT ACGACAACTAT;
let-7f-5p引物,正向:5′-CGCGCGTGAGGTAGTAGATTGT-3′;let-7e-5p引物,正向:5′-CGCGTGAGGTAGGAGGTTGT-3′;let-7a-5p引物,正向:5′-GCGCGTGAGGTAGT AGGTTGT-3′;let-7 miRNA引物,反向:5′-AGTGCAGGGTCCGAGGTATT-3′;U6引物,正向:5′-CTCGCTTCGGCAGCACA-3′,反向:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.8Western blot(WB)检测Erk磷酸化水平 SH-SY5Y细胞经OGD/R及外泌体处理后收集细胞并提取蛋白质,参考文献[12],采用WB测定Erk总蛋白表达水平及磷酸化水平,以β-Actin作为内参。
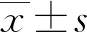
2.1星形胶质细胞外泌体的鉴定 利用透射电镜观察外泌体的立体结构,显示30~100 nm的双膜结合小泡。使用流式细胞术检测外泌体表面标记物CD81和CD63的表达,均呈阳性,分别为82.2%和67.6%。
2.2原始数据的筛选分析 在本研究缺糖缺氧再灌注组(OGD/R)与正常对照组的总共3组标本中,经过高通量Illumina MiSeq测序,共获得了原始数据(Raw reads)2.37×107(对照组),2.66×107(OGD 4 h组),2.54×107(OGD 4 h/R 24 h)。经过数据筛选后,所获取的有效数据量在各组相应的数据总量中占比分别达到了37.41%(对照组),35.66%(OGD 4 h组),39.77%(OGD 4 h/R 24 h组)。数据的质与量满足进一步的深度生物信息学分析质控要求。
2.3OGD及OGD/R对星形胶质细胞外泌体miRNAs表达谱的影响 OGD 4 h处理,使外泌体中miR-384-5p、miR-421-3p_R+3、miR-361-5p、miR-16-5p、miR-24-3p、miR-25-3p、miR-92b_R+1、miR-128-3p、miR-151-3p表达显著下调(P<0.05),而let-7家族成员,如let-7f-5p、let-7e-5p、let-7a-5p、let-7d-5p和miR-98-5p_R-1,以及miR-23b_R+1和miR-30c-5p_R-1表达显著上调(P<0.05,差异倍数≥2,mapped reads≥1 000)。再灌注24 h处理后,let-7家族成员表达开始下调,恢复至与对照组比较差异无统计学意义的水平(P>0.05),OGD 4 h处理导致的表达下调的miRNAs也恢复至和对照组比较差异无统计学意义的水平(P>0.05)。OGD 4 h/R 24 h组与对照组比较,在同时满足P<0.05,差异倍数≥2,mapped reads≥1 000的条件下,只有miR-122-5p_R-1的表达差异有统计学意义(P<0.05)。见表1、2。

表1 OGD 4 h组和对照组的比较

续表1 OGD 4 h组和对照组的比较

表2 OGD 4 h/R 24 h和OGD 4 h组的比较
2.4qPCR验证 为了进一步验证miRNAs表达水平的变化。本研究从2.3中差异有统计学意义的miRNAs中选择了let-7家族成员let-7a-5p、let-7e-5p、let-7f-5p进行qPCR验证。结果发现,这3种miRNAs在外泌体中的分布水平远高于细胞(P<0.05),即let-7a-5p、let-7e-5p和let-7f-5p主要富集在外泌体中,而这种富集作用不受OGD刺激的影响。此外,OGD 4 h组外泌体中let-7a-5p表达水平高于对照组外泌体中的表达水平(P<0.05),而let-7e-5p和let-7f-5p的表达水平与对照组比较,差异无统计学意义(P>0.05)。见图1。

注:与对照组比较,**P<0.01;
Con exo表示对照组外泌体;
Con exo表示OGD 4 h组外泌体。
2.5KEGG富集分析 从对照组、OGD 4 h组和OGD 4 h/R 24 h组中分别挑选出高表达的miRNAs(高于平均值),用metascape和miRWalk预测靶基因,挑选出共同的靶基因在Webgestalt中进行KEGG富集分析。3组中,外泌体高表达miRNAs的靶基因所涉及的信号通路主要为代谢相关通路,如PI3K-AKT、MAPK和mTOR信号通路。3组中外泌体miRNAs富集的信号通路基本相同,3组中富集分析排列在第1位到第9位的信号通路全部相同;
而在富集到的前20条信号通路中只有两条信号通路有所差别;
3组间存在少许差异,如OGD 4 h组中没有富集到Wnt信号通路,OGD 4 h/R 24 h组中没有富集到AMPK信号通路。
2.6星形胶质细胞外泌体和OGD处理对SH-SY5Y细胞Erk信号通路的影响 为了进一步验证外泌体和OGD处理对2.5中分析得到的信号通路的影响,选择了MAPK/Erk信号通路实验验证。分别提取了星形胶质细胞对照组、OGD 2 h组、OGD 4 h组、OGD 2 h/R 24 h组、OGD 4 h/R 24 h组分泌的外泌体,分别作用于相同处理的SH-SY5Y细胞,然后提取细胞总蛋白,对p-Erk1、p-Erk2蛋白和Erk1、Erk2蛋白表达进行测定。OGD 2 h和OGD 4 h处理使SH-SY5Y细胞p-Erk水平下调(P<0.05),而给予OGD 2 h和4 h的星形胶质细胞外泌体则能逆转OGD 2 h和4 h诱导的SH-SY5Y细胞p-Erk水平的下调(P<0.05)。OGD 2 h/R 24 h和OGD 4 h/R 24 h处理促使SH-SY5Y细胞p-Erk水平下调(P<0.05),而给予OGD 2 h/R 24 h和OGD 4 h/R 24h处理的星形胶质细胞外泌体则能逆转OGD 2 h/R 24 h和OGD 4 h/R 24 h诱导的SH-SY5Y细胞p-Erk水平的下调(P<0.05)。此外,给予正常状态星形胶质细胞分泌的外泌体进行处理也能显著上调正常条件下培养的SH-SY5Y细胞的p-Erk1、p-Erk2水平(P<0.05)。见图2。

注:Con表示对照;
exo表示外泌体;
与对照比较,*P<0.05,**P<0.01;
与OGD或CGD/R处理组比较,#P<0.05,##P<0.01;A、B分别表示对细胞进行OGD 2、4 h处理;C、D分别表示对细胞进行OGD 2 h/R 24 h、OGD 4 h/R 24 h处理。
星形胶质细胞在缺血性脑卒中的发生、发展及后期的恢复过程中均发挥重要的调节作用。脑缺血后,在受影响脑区的星形胶质细胞是最早对缺血作出反应的细胞,形成反应性星形胶质细胞,通过大量突起、分泌胶质细胞来源递质及外泌体等与脑内其他细胞建立密切的信息联系[13-15]。有文献报道,对星形胶质细胞做不同的处理会刺激细胞释放出具有不同生物学作用的外泌体。如使用β-淀粉样蛋白作用于小鼠大脑皮层星形胶质细胞,会引起星形胶质细胞分泌富含神经酰胺和前列腺凋亡反应蛋白4的外泌体,这些外泌体可作用于星形胶质细胞自身及其周围神经元,促进星形胶质细胞和神经元的凋亡[16]。而热应激则引起星形胶质细胞释放含有大量Hsp/c70的外泌体,该外泌体可能对星形胶质细胞周围神经元的存活起关键作用[17]。
不同程度的OGD处理会造成不同程度的星形胶质细胞损伤,也可能导致星形胶质细胞增殖[18-19]。OGD处理不同时间导致的星形胶质细胞状态改变也对神经元产生保护或损伤的不同作用。这可能与不同时间OGD处理会促使星形胶质细胞递质、外泌体等释放的改变有关。在研究采用OGD 4 h处理星形胶质细胞后,其外泌体miRNAs表达谱发生了明显改变。其中miRNAs let-7家族成员,包括let-7f-5p、let-7e-5p、let-7a-5p、let-7d-5p,以及miR-98-5p表达水平在OGD处理后上调。选取let-7a-5p、let-7e-5p和let-7f-5p进行qPCR验证,结果显示OGD处理上调了外泌体中let-7a-5p的表达水平。miRNAs let-7家族是最早被研究的miRNAs之一,参与多种疾病的发生、发展,如癌症、炎症、免疫性疾病等[20]。最近,有研究发现let-7家族成员也参与了脑卒中的发生、发展,如JIANG等[21]发现miRNA let-7参与调节酸敏感离子通道1α的表达,继而可能影响脑卒中等疾病后脑神经功能的损伤和修复。有学者在SD大鼠短暂性大脑中动脉阻塞模型(tMCAO)和tMCAO加短暂性股动脉闭塞处理模型中发现tMCAO可诱导let-7a等11个miRNAs的上调;
短暂性股动脉闭塞可能通过抑制let-7a等miRNAs的上调,发挥对tMCAO后脑组织的保护作用;
而侧脑室注射let-7a模拟物可逆转短暂性股动脉闭塞对tMCAO后脑组织的保护作用[22]。此外,有研究在72例急性期缺血性卒中患者中发现血清和脑脊液中let-7e表达水平显著升高,且具有高度一致性;
血清let-7e作为缺血性脑卒中急性期生物标志物的特异度高达73.4%,灵敏度为82.8%[23]。结合本研究的结果,笔者认为缺血可促进星形胶质细胞等神经细胞释放外泌体,而外泌体内含有的大量miRNAs,包括let-7家族成员等释放进入循环系统。这也符合本研究的另一个发现,miRNAs在星形胶质细胞内主要分布于外泌体中,而缺血后外泌体的释放会显著影响血清或脑脊液内miRNAs的水平。
处理结果中所列出的表达受影响的miRNAs外,绝大部分miRNAs表达水平均没有受OGD处理的影响。本研究将3组中高表达的miRNAs进行靶基因预测再进行KEGG富集分析,结果提示OGD 4 h处理对大部分星形胶质细胞外泌体miRNAs靶基因信号通路的影响不大,3组间仅存在少许差异,如OGD 4 h组中没有富集到Wnt信号通路,OGD 4 h/R 24 h组中没有富集到AMPK信号通路。选取MAPK/Erk信号通路做进一步的实验验证,发现来自对照组星形胶质细胞的外泌体处理对照组SH-SY5Y细胞,或者来自OGD处理组和OGD/R处理组星形胶质细胞的外泌体均可以使对应处理的SH-SY5Y细胞的p-Erk1、p-Erk2水平上调,提示星形胶质细胞外泌体对Erk信号通路的调节可能是通过其miRNAs发挥作用的。此外,有文献报道Erk信号通路在突触形成和神经元可塑性中起重要作用[24]。因此,笔者猜测,星形胶质细胞外泌体可能通过miRNAs介导的Erk信号通路调节神经元的可塑性。
综上所述,OGD处理显著影响星形胶质细胞外泌体miRNAs的表达。正常对照组、OGD和OGD/R处理组外泌体中高浓度分布的miRNAs均靶向作用于代谢相关通路,如PI3K-AKT、MAPK和mTOR等信号通路。
猜你喜欢 星形外泌体胶质 星形诺卡菌肺部感染1例并文献复习传染病信息(2022年2期)2022-07-15外泌体miRNA在肝细胞癌中的研究进展昆明医科大学学报(2022年2期)2022-03-29间充质干细胞外泌体在口腔组织再生中的研究进展昆明医科大学学报(2021年5期)2021-07-22循环外泌体在心血管疾病中作用的研究进展老年医学研究(2021年6期)2021-03-09人类星形胶质细胞和NG2胶质细胞的特性神经损伤与功能重建(2020年11期)2020-12-01小胶质细胞——阿尔茨海默病中重新回炉的热点广东医科大学学报(2020年6期)2020-02-06带有未知内部扰动的星形Euler-Bernoulli梁网络的指数跟踪控制数学物理学报(2019年3期)2019-07-23外泌体在肿瘤中的研究进展国际呼吸杂志(2019年8期)2019-04-29“8字形”快速突破“星形”角度问题初中生世界·七年级(2018年7期)2018-09-07视网膜小胶质细胞的研究进展湖南中医药大学学报(2016年1期)2016-12-01 相关热词搜索:星形,胶质,灌注,






