猪圆环病毒2型单管巢式PCR检测方法建立
时间:2023-02-14 16:55:08 来源:千叶帆 本文已影响人
夏嘉鑫,岳丰雄,林 艳
(成都天邦生物制品有限公司,四川 成都 610100)
猪圆环病毒(PCV)是1974年Tischer等在PK-15传代细胞系中发现的,属于圆环病毒科圆环病毒属[1]。血清型有猪圆环病毒1型(PCV1)和猪圆环病毒2型(PCV2),病毒粒子大小为14~25 nm,呈对称的二十面体,为无囊膜单股环状负链DNA病毒,是目前已知最小的动物病毒,PCV2基因组全长1 768 bp或1 767 bp[2]。
近年来的研究表明,猪圆环病毒在我国广泛流行,为了及时控制该病,减少猪圆环病毒病带来的损失,生产中急需一种快速、准确的诊断方法。目前检测PCV2抗原的分子生物学检测方法包括聚合酶链反应、巢式PCR技术(Nested PCR,nPCR)、实时荧光定量PCR技术(Quantitative Real-time PCR, QPCR)等。
聚合酶链反应(Polymerase chain reaction,PCR)是1983年由美国研究人员发明的,利用DNA的天然复制过程,对DNA片段短时间内进行数百万倍扩增,再利用核酸电泳跑胶并染色的方式于紫外下观察,从而检出核酸含量极少的样品,但其精确度依旧不是太高,无法应对现有的检测要求。实时荧光定量PCR技术是通过荧光标记探针或添加荧光染料进行定量功能检测,能够对病毒核酸进行精确定量,弥补了普通PCR定性检测的不足,但其检测成本和要求比较高[3]。
巢式PCR检测首先使用外引物首次PCR,第1轮低循环数(10~20个)的作用是增加自然DNA模板量,以产生足够数量的合成模板供第2轮使用,放大后的产品在第2轮循环中作为模板。通常情况下,与单轮PCR相比,nPCR是一种非常敏感的检测方法,可以检测极低拷贝数的靶DNA。在特异性方面,与单轮PCR相比,nPCR减少了产生非特异性产物的可能性,而单轮PCR具有较高的循环数(40个循环),这是因为nPCR在第1轮产生的错误引物非特异性序列扩增率非常低,因为这些非特异性序列不包含内引物的结合位点[4]。
虽然nPCR技术由于其优越的性能已经检测了各种微生物制剂,但它容易受到污染和人为因素的影响。这些问题主要是由于第1轮扩增材料在移液过程中产生的污染,从而为第2轮制备模板[5]。为了克服这一问题,我们开发了一种改进的nPCR检测方法,即两轮扩增在同一试管中进行,在第1轮后不需要打开PCR管,该体系被命名为单管巢式PCR[6]。单管巢式PCR的成功在很大程度上依赖于两套引物之间的干扰最小化。
该干扰最小化是通过设计两套不同退火温度的引物来实现的。通常,第1轮是在较高的退火温度(高温轮)下进行的,并使用相对较高的熔化温度(Tm)的外引物。第2轮(低温轮)在较低的退火温度下进行,使用具有较低Tm的内(嵌套)引物来扩增第1轮产生的扩增子的内部片段[7-9]。
1.1 试验时间与地点
相关试验于2021年4月1—23日在成都天邦生物制品有限公司研发部实验室完成。
1.2 受试材料与试剂
猪圆环病毒2型DBN-SX07株、ZJ/c毒株为成都天邦生物制品有限公司研发部实验室保存;
DNA核酸提取试剂盒[TIANGEN生化科技(北京)有限公司-DP304];
2×Taq PCR Mastermix、DL 2 000 DNA Marker均购自天根生化科技(北京)有限公司;
KAPA PROBE FAST Universal(KAPA BIOSYSTEMS/REF:KK4702 07959818001)。
1.3 主要仪器
PCR仪[Nexus gradient(艾本德)];
荧光定量PCR仪(applied biosystems/QuantStudio3);
琼脂糖水平电泳仪(北京六一生物科技有限公司,DYCP-31BN型);
微量分光光度计NanoPhotometer-N60系列(德国IMPLEN)。
1.4 单管巢式PCR引物设计与合成
外引物根据国家标准GB/T 21674—2008猪圆环病毒聚合酶链反应试验方法合成,引物序列详见表1。内引物根据GenBank中登录的PCV2全基因序列(登录号:MW268739.1)使用DNAStar软件的MegAlign程序进行比对,利用软件Primer 6.0及外引物序列设计出一对内引物,引物序列详见表1,参考引物设计原理,并结合单管巢式PCR引物设计要求:一般外引物退火温度高于内引物10 ℃左右。QPCRPCV2特异性引物探针按照参考文献Yu-Liang Huang合成,引物探针序列详见表1[10]。引物均委托生工生物工程(上海)股份有限公司合成。

表1 引物信息
1.5 单管巢式PCR检测体系的建立及条件优化
为了得到理想的单管巢式PCR检测体系,首先需要DBN-SX07株、ZJ/c毒株DNA核酸模板,并开展内外引物退火温度的单因素试验,在此基础上进行内外引物浓度、Ex Taq酶用量等关键因素的正交试验。
1.5.1 猪圆环病毒2型DBN-SX07株、ZJ/c毒株DNA核酸模板制备 用TIANGEN公司的DNA核酸提取试剂盒提取猪圆环病毒2型DBN-SX07株、ZJ/c毒株基因组DNA,具体步骤参考使用说明书。
1.5.2 内外引物最佳退火温度的单因素试验 为了优化圆环单管巢式PCR的内外引物最佳退火温度,在其他因素不变的情况下,先对内引物退火温度设定62 ℃、61.4 ℃、60.3 ℃、58.2 ℃、55.6 ℃、53.6 ℃、52.2 ℃、51.5 ℃共计8个温度梯度,筛选出最佳内引物退火温度后,在此基础上对外引物退火温度设定68 ℃、66.4 ℃、64.4 ℃、62 ℃、60 ℃、58 ℃共计6个温度梯度。从中筛选出高于内引物最佳退火温度大约10 ℃的外引物作为最佳退火温度。
圆环内引物PCR扩增采用20 μL反应体系:ddH2O 7 μL,2×Taq PCR Mastermix 10 μL,10 μmol/L正反向引物各1 μL,模板DNA 1 μL。PCR反应程序:94 ℃预变性5 min;
94 ℃变性45 s,以梯度温度退火1 min,72 ℃延伸25 s,30个循环;
72 ℃延伸10 min,4 ℃保存。
圆环外引物PCR扩增采用25 μL反应体系:ddH2O 8 μL,2×Taq PCR Mastermix 12.5μL,10 μmol/L正反向引物各1 μL,模板DNA 2.5 μL。PCR反应程序:94 ℃预变性3 min;
94 ℃变性30 s,以梯度温度退火45 s,72 ℃延伸45 s,35个循环;
72 ℃延伸10 min,4 ℃保存。
1.5.3 单管巢式PCR反应体系正交试验 在单因素试验的基础上,对单管巢式PCR反应体系的3个因素(内外引物,2×Taq酶)各设定4个水平(表2),选用正交表L16(45)设计试验(表3)。各试验总体积为25 μL,每个试验均加入DNA模板2.5 μL,其他成分按照正交设计的浓度或用量加入,以ddH2O补足25 μL。PCR反应第1轮:94 ℃预变性3 min;
94 ℃变性30 s,外引物最佳退火温度退火30 s,72 ℃延伸1 min,20个循环,72 ℃延伸10 min;
第2轮:94 ℃预变性3 min;
94 ℃变性30 s,内引物最佳退火温度退火30 s,72 ℃延伸25 s,40个循环,72 ℃延伸10 min。PCR扩增产物进行2%琼脂糖凝胶电泳(40 min),于凝胶成像仪观察并拍照。

表2 单管巢式PCR反应体系正交试验的各因素及水平
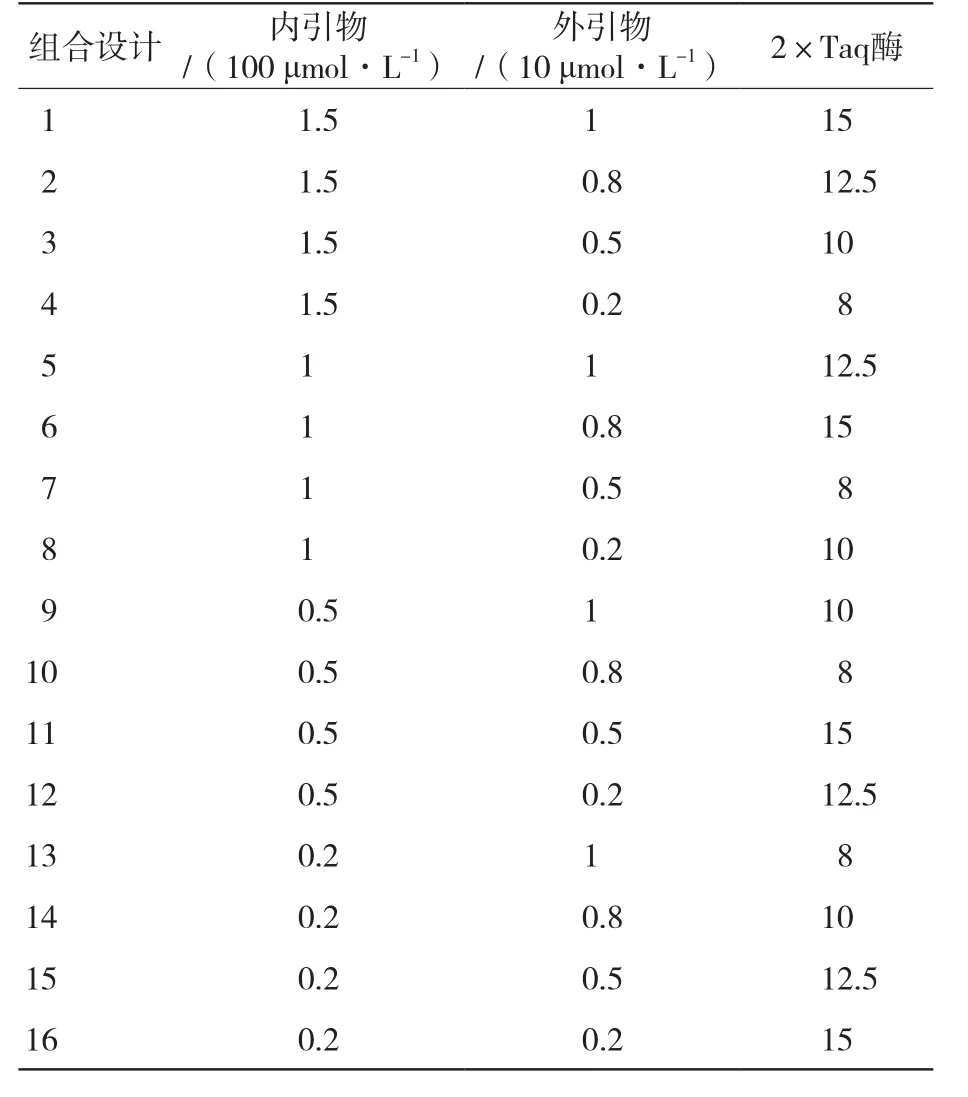
表3 单管巢式PCR不同因素和水平的L16(45)正交试验设计
1.5.4 特异性分析 利用上述优化后的条件进行单管巢式PCR检测。以猪圆环病毒2型DBN-SX07株为阳性对照,以ddH2O为阴性对照,其他样品以如下易感猪源病毒的基因组DNA或cDNA为模板:猪细小病毒(PPV)、猪伪狂犬病病毒(PRV)、猪肺炎支原体(MHP)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪繁殖与呼吸综合征病毒(PRRSV)、牛病毒性腹泻病毒(BVDV),扩增产物进行电泳,观察有无条带以及条带是否单一,从而判定该检测引物对的特异性。
1.6 单管巢式PCR检测体系与实时荧光PCR检测灵敏度对比分析
利用超微量核酸蛋白测定仪将猪圆环病毒2型DBN-SX07株、ZJ/c毒株DNA初始浓度采用浓度梯度稀释法稀释为0.6 ng/μL、60 pg/μL、6 pg/μL、0.6 pg/μL、60 fg/μL、6 fg/μL、0.6 fg/μL、60 ag/μL、6 ag/μL、0.6 ag/μL;
以ddH2O作为阴性对照,分别进行普通巢式PCR和单管巢式PCR检测、实时荧光PCR检测。扩增产物进行2%琼脂糖凝胶电泳,于凝胶成像仪观察并拍照,实时荧光PCR记录到达平台期的CT循环数。
2.1 最佳退火温度的筛选
为了确定单管巢式PCR内外引物的退火温度,首先在对内引物PCV2-1/2进行梯度退火温度筛选。结果显示,在供试的8个梯度退火温度中,在51.5~62 ℃共8个梯度均出现扩增条带(图1),且特异性很好,考虑到外引物最佳退火温度及单管巢式PCR内外引物退火要求,本研究选取54.4 ℃为最佳内引物退火温度开展后续试验。对外引物PCV2-P1/P3进行梯度退火温度筛选。结果显示,在供试的6个梯度退火温度中,在58~66.4 ℃共5个梯度均出现扩增条带(图2),在62~66.4 ℃非特异性条带浅,根据上述结果,考虑到内引物最佳退火温度及单管巢式PCR内外引物退火要求,本研究选取64.4 ℃为最佳外引物退火温度开展后续试验。

图1 内引物最佳退火温度确定

图2 外引物最佳退火温度确定
2.2 单管巢式PCR检测体系筛选
由于单管巢式PCR以第1轮PCR产物为模板进行扩增,可通过控制外引物用量使外引物耗尽而停止有效扩增。为此,利用SPSS软件对内外引物浓度、2×Taq酶关键因素进行正交试验设计,以筛选出最佳组合。结果显示,在16种组合中,只有组合8的扩增条带单一且清晰且非特异性几乎没有,即当外引物浓度为2 μmol/L、内引物浓度为100 μmol/L、2×Taq酶为10 μL,反应条带最清晰(图3)。综上所述,本研究建立的猪圆环病毒2型单管巢式 PCR反应体系为:ddH2O 10.1 μL,2×Taq酶10 μL,10 μmol/L外引物PCV2-P1/P3各0.2 μL,100 μmol/L外引物PCV2-1/2各1 μL,模板DNA 2.5 μL;
第1轮反应程序:94 ℃预变性3 min;
94 ℃变性30 s,64.4 ℃退火30 s,72 ℃延伸1 min,20个循环;
72 ℃延伸10 min;
第2轮反应程序:94 ℃预变性 3 min,94 ℃变性 30 s,54.4 ℃退火 30 s,72 ℃ 延伸25 s,40个循环;
72 ℃延伸10 min,4 ℃保存。

图3 单管巢式PCR正交试验
2.3 单管巢式PCR检测体系的特异性分析
利用所建立的单管巢式PCR检测体系,对猪圆环病毒2型DNA、猪源易感染病毒共计8份样品进行单管巢式PCR扩增,以检测该体系的特异性。结果显示,只有猪圆环病毒2型DNA出现目的条带,其余病毒DNA均未检测出条带(图4)。上述结果表明,所建立的猪圆环病毒2型单管巢式PCR检测体系具有良好的特异性。

图4 单管巢式PCR特异性试验
2.4 灵敏度对比分析
将猪圆环病毒2型DBN-SX07株、ZJ/c毒株的DNA浓度调整至0.6 ng/μL,吸光度测定结果显示,OD260/OD280为1.8~1.9,OD260/OD230大于2.0。以10倍梯度进行稀释作为模板,进行普通PCR的灵敏度检测和单管巢式PCR以及实时荧光PCR检测。
普通PCR检测结果显示,当DBN-SX07株DNA模板浓度为0.6~60 fg/μL时,均检测出目的条带,但有非特异扩增;
当ZJ/c毒株DNA模板浓度为0.6~60 pg/μL范围时,均检测出单一的目的条带(图5)。

图5 外引物灵敏度试验
单管巢式PCR检测结果显示,当DBN-SX07株DNA模板浓度为0.6 ng/μL至0.6 fg/μL范围时,均检测出目的条带;
当ZJ/c毒株DNA模板浓度为0.6 ng/μL~0.6 pg/μL范围时,均检测出单一清晰的目的条带(图6)。
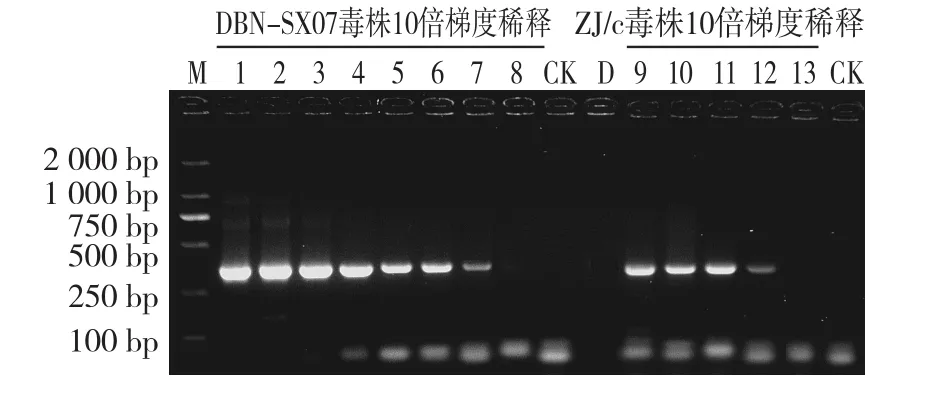
图6 单管巢式PCR灵敏度优化试验
实时荧光PCR检测结果显示,当DBN-SX07株DNA模板浓度为0.6 ng/μL~6 ag/μL范围时,均有特异性曲线扩增且检测出CT值;
当ZJ/c毒株DNA模板浓度为0.6 ng/μL~6 fg/μL范围时,均有特异性曲线扩增且检测出CT值,因此,针对圆环病毒2型所建立的单管巢式PCR检测对DBN-SX07株的最低限为0.6 fg/μL,ZJ/c毒株的最低限为0.6 pg/μL;
而普通PCR对DBN-SX07株的最低限为60 fg/μL,ZJ/c毒株的最低限为60 pg/μL;
实时荧光PCR对DBN-SX07株的最低限为6 ag/μL,ZJ/c毒株的最低限为6 fg/μL。
目前PCR技术的优点是敏感、特异、快速、准确,是进行病原检测和定型的常用方法。而多重PCR、巢氏PCR、定量竞争PCR的出现使得PCR技术的应用更为广泛。PCV2是断奶仔猪多系统衰竭综合征(PMWS)的病因之一。由于病毒粒子很小、在细胞培养过程中不产生细胞病变,常规的病毒分离鉴定方法很难鉴定该病毒。由于PCV2是DNA病毒,易于抽提核酸,并从核酸水平对病毒进行检测和研究。PCR方法可以快速准确检测感染病例组织样品中的PCV2核酸,该方法敏感、特异,是检测PCV2和实验室诊断猪圆环病毒病的有效手段。Larochelle等构建了多重PCR检测方法来检测和鉴定长期感染PK15细胞的猪圆环病毒(PCV1)和引起PMWS的PCV2[11]。
本研究通过建立一种单管巢式PCR检测方法,单管巢式PCR是在一个管中加入2对引物进行2次扩增,比常规的巢式PCR减少了反应时间和操作步骤,而且减少了污染的可能性。影响单管巢式PCR成功率的因素主要有引物浓度、dNTPs浓度、引物设计、Ex Taq酶用量和温度设置等。其中引物浓度配比和退火温度又是最为关键的因素[12]。很多学者都对PCR检测方法进行了大量的研究,他们扩增的目的片段大小不一样,建立的PCR都有很好的特异性和重复性,只是灵敏度不一样。唐万寿等扩增目的片段为493 bp,检测出目的基因的最低DNA模板量为1×10-4ng[13];
郑玉姝等扩增目的片段为482 bp,检测出目的基因的最低DNA模板量为1×10-4ng[14]。
与实时荧光定量PCR方法相比,李雪峰等建立的QPCR方法检测出目的基因的最低DNA模板量102.0TCID50/mL,比普通PCR方法高100倍[15];
李晓菲等建立的QPCR方法检测出目的基因的最低DNA模板量5.0×101拷贝/μL,比普通PCR方法高100倍[16];
石林等建立的QPCR方法检测出目的基因的最低DNA模板量8.828×101拷贝/μL[17];
通过本试验建立的圆环病毒2型单管巢式PCR检测方法对易感猪源病毒不敏感,针对猪圆环病毒2型特异性强,扩增目的片段为353 bp,检测出DBNSX07株目的基因的最低DNA模板量为1×10-6ng,检测出ZJ/c毒株目的基因的最低DNA模板量为1×10-3ng,灵敏度比普通PCR高10倍,但比实时荧光定量PCR低10倍。
不同于传统的巢式PCR中途需开盖的方式,单管巢氏PCR可一步将所有试剂均一次性加入PCR单管中,在高浓度的内引物及低浓度的外引物作用下,先一步扩增出外引物扩增产物,再在扩增产物及内引物基础上扩增目的片段产物,既保证了PCR的灵敏性,也避免PCR扩增产生的气溶胶污染第2轮的PCR扩增。相比于实时荧光PCR检测,灵敏性有所不足,但考虑到实时荧光PCR检测较常规检测试剂及仪器设备太昂贵,同时检验过程中易出现假阳性的现象,单管巢氏PCR在样品的实际检测过程中,仍具有很大的应用价值。
本研究设计的单管巢式PCR具有很好的灵敏性和特异性,可用于猪圆环病毒2型(PCV2)的核酸检测。
猜你喜欢 圆环毒株特异性 CT联合CA199、CA50检测用于胰腺癌诊断的敏感性与特异性探讨现代仪器与医疗(2022年4期)2022-10-08圆环填数小猕猴学习画刊(2022年6期)2022-06-30老年慢性非特异性腰痛综合康复治疗效果分析健康体检与管理(2022年4期)2022-05-13法国发现新冠新变异毒株IHU科学大观园(2022年2期)2022-01-23奥密克戎毒株为何“需要关注”文萃报·周二版(2021年47期)2021-12-14感染两种新冠变异毒株比利时九旬老人病逝环球时报(2021-07-12)2021-07-12巧剪圆环小天使·二年级语数英综合(2017年10期)2017-10-31成语圆环小学阅读指南·低年级版(2017年1期)2017-03-13转动戒指三联生活周刊(2016年43期)2016-10-28婴幼儿湿疹800例血清过敏原特异性IgE检测结果分析中国实用医药(2016年9期)2016-05-17 相关热词搜索:圆环,检测方法,病毒,






