基于TLR4介导的信号通路探讨人参皂苷Rg1抗脑缺血再灌注损伤的作用
时间:2023-02-15 17:30:08 来源:千叶帆 本文已影响人
马雪飞 冯冬军 于文霞 谭明 刘跃 翟凤国
脑卒中(Cerebral stroke)是一种急性脑血管疾病。据推算,我国脑卒中患者约为1 300万,而缺血性脑卒中占脑卒中人数的70%以上[1,2]。静脉化学溶栓是目前治疗缺血性脑卒中的主要治疗手段之一,然而,通过溶栓治疗恢复血流量会损害脑组织,造成脑缺血再灌注(I/R)损伤。目前脑I/R损伤的作用机制尚不明确,但炎症反应是脑I/R损伤发病过程中的关键部分,有研究指出,减少炎症因子的分泌或加强抗炎因子的表达可以缩小脑I/R损伤大鼠脑梗死体积,有助于神经功能恢复[3]。Toll样受体4(TLR4)作为Toll样受体识别系统,是一个参与固有免疫反应的模式识别受体蛋白,MyD88是TLR4介导炎症通路重要的胞内接头蛋白,可以募集下游信号分子的N端死亡结构域(Death domain,DD)和承接TLRs活化信号的C端TIR结构域,NF-κB是TLR4/MyD88下游的重要节点,参与转录调控,可导致炎症因子释放[4]。人参皂苷Rg1是人参的主要提取物之一,有研究发现,人参皂苷Rg1可以通过激活Nrf 2/ARE信号通路,减小脑I/R损伤大鼠的脑梗死体积[5];
也有研究表明,人参皂苷Rg1可以通过激活PPARγ/HO-1信号通路缓解脑I/R损伤大鼠神经元凋亡[6]。但关于人参皂苷Rg1是否通过TLR4/MyD88/NF-κB信号通路发挥脑保护作用的研究较少。本研究通过建立脑I/R损伤大鼠模型,比较不同剂量的人参皂苷Rg1对脑I/R损伤大鼠的影响,为进一步探讨人参皂苷Rg1对大鼠脑I/R损伤的保护作用提供理论依据。
1.1 实验动物 6~8周SPF级SD(Sprague Dawley)大鼠60只,重量为250~300g,来自牡丹江医学院比较医学中心,动物许可证号为SYXK(黑)2019-006。大鼠自由获取食物和水,室温25℃恒定,模拟昼夜光照,在牡丹江医学院比较医学中心饲养(SCXK2019-003)。严格按照中国实验动物管理法规处理动物,实验中所有动物严格遵循3R原则。
1.2 试剂 人参皂苷Rg1购自上海源叶生物技术有限公司;
大鼠白细胞介素1β(IL-1β)、大鼠白细胞介素6 (IL-6)、大鼠肿瘤坏死因子-α(TNF-α)、ELISA试剂盒、RNA提取试剂盒、逆转录试剂盒、SYBR Green PCR Master mix、ECL化学发光底物试剂盒均购自北京华诺德生物科技有限公司;
一抗TLR4、MyD88、NF-κB、β-actin、山羊抗兔二抗等以上抗体均购自上海优宁维生物科技股份有限公司。
1.3 方法
1.3.1 实验分组、给药及模型的建立 将SD大鼠随机分为4组:假手术组、脑I/R损伤模型组、低剂量给药组(人参皂苷Rg1 30mg/kg)及高剂量给药组(人参皂苷Rg1 60mg/kg),各15只。假手术组与脑I/R损伤模型组分别于术前每天1次腹腔内注射生理盐水,低、高剂量给药组每天1次腹腔内注射人参皂苷Rg1,连续给药5天。末次给药30min后,采用颈内动脉线栓法致大鼠大脑中动脉阻塞引起脑I/R损伤模型,即在大鼠颈正中部做切口,暴露右侧颈总动脉、颈外动脉和颈内动脉,结扎颈总动脉和颈外动脉,于颈总动脉分叉下方剪1个“V”形切口,将事先准备好的尼龙线栓轻轻插入颈内动脉18~20mm处,当感到有明显阻力时,提示线栓已经栓在中动脉起始部位,达到阻塞动脉,即停止插栓线。阻闭90min后,将线栓缓慢拔出,恢复再灌注24h,形成大鼠脑I/R损伤。假手术组只暴露血管、缝合,不进行任何其他操作。
1.3.2 各组大鼠运动神经功能缺损评分比较 待脑I/R损伤24h后,观察大鼠的精神状态,根据Longa等[7]的评分标准对各组大鼠进行评分,0分:无神经系统损伤症状,活动正常;
1分:提尾时,左前肢屈曲;
2分:行走时身体向左侧转圈;
3分:向左侧倾倒;
4分:不能自发行走,意识丧失。各组大鼠运动神经功能缺损评分分值越高,提示大鼠神经功能障碍越严重,取1~3分大鼠用于后续实验。
1.3.3 炎症因子水平检测 按照ELISA检测试剂盒说明书中的操作步骤进行实验操作。分别检测各组大鼠血浆IL-1β、IL-6、TNF-α水平。
1.3.4 qRT-PCR法检测大鼠皮层脑组织中TLR4的表达 取各组大鼠的皮层脑组织样本约100mg,提取皮层脑组织中总RNA,用超微量核酸蛋白测定仪测定RNA浓度。将提取的RNA逆转录成cDNA,经SYBR Green荧光染色法对各组大鼠皮层脑组织中TLR4 mRNA的表达情况进行测定。内参选取β-actin,以2-ΔΔCt法来对TLR4 mRNA表达情况进行计算。实验中的所有引物均由英潍捷基上海贸易有限公司合成,TLR4基因的引物序列(5"-3")为F:CTAGTCGACGAGATGGCGCTGCAT,R:CGCGGATCC ACTACAACAGGCAGATCAAC;
β-actin基因的引物序列(5"-3")为F:GGAGATTACTGCCCTGGCTCCTA,R:GACTCATCGTACTCCTGCTTGCTG。
1.3.5 Western blot检测大鼠皮层脑组织中各目的蛋白水平的表达 取各组皮层脑组织样本约100mg,加入0.2ml预冷的蛋白裂解缓冲液(RIPA组织-细胞快速裂解液∶蛋白磷酸酶抑制剂=100∶1),用研磨棒在冰上充分研磨,4℃摇床充分裂解30min,4℃12 000r/min离心15min,吸取上清液,用BCA蛋白浓度测定试剂盒测定各组总蛋白的浓度。按照15μl上样量含有40μg蛋白样品进行SDSPAGE电泳,湿法电转至PVDF膜上,5%脱脂奶粉封闭1h后,分别加入MyD88(兔抗大鼠1∶500稀释)、NF-κB(兔抗大鼠1∶1 000稀释)、TLR4(兔抗大鼠1∶300稀释)、β-actin(兔抗大鼠1∶2 000稀释)一抗4℃孵育过夜,PBST缓冲液(1 000ml PBS加入0.5ml Tween 20)洗涤3次,每次10min,加入HRP标记的山羊抗兔二抗(1∶10 000稀释)孵育1h,PBST缓冲液洗涤3次,每次10min,最后用ECL化学发光试剂显色,化学发光成像仪曝光、取像并测定条带灰度值,各组灰度测定值与β-actin灰度值比值作为实验结果。
1.4 统计学分析 采用SPSS 21.0软件进行统计分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析法(One-way ANOVA),组间比较采用最小显著性差异法(LSD),P<0.05为差异具有统计学意义。
2.1 各组大鼠运动神经功能缺损评分比较 由于本实验仅选择神经功能缺损评分为1~3分的大鼠为实验对象,根据每组的实际情况,从中选择8只大鼠进行运动神经功能缺损评分的比较。脑I/R损伤模型组大鼠运动神经功能缺损评分为(2.13±0.64)分,明显高于假手术组的0分(P<0.01);
与脑I/R损伤模型组比较,低剂量给药组大鼠运动神经功能缺损评分为(1.38±0.52)分稍低(P<0.05),而高剂量给药组大鼠运动神经功能缺损评分为(1.23±0.35)分明显较低(P<0.01)。
2.2 各组大鼠血浆TNF-α、IL-6、IL-1β水平比较 在本实验中,随机从上述每组中各选6只大鼠对血浆进行TNF-α、IL-6、IL-1β炎症因子水平的检测。与假手术组比较,脑I/R损伤模型组大鼠血浆TNF-α、IL-6、IL-1β水平均明显较高(P<0.01);
与脑I/R损伤模型组相比,人参皂苷Rg1预处理的大鼠血浆TNF-α、IL-6、IL-1β水平随着给药剂量的增加而减少(P<0.01),呈剂量相关。见表1。
表1 各组大鼠血浆TNF-α、IL-6、IL-1β水平(±s,n=6)

表1 各组大鼠血浆TNF-α、IL-6、IL-1β水平(±s,n=6)
注:与假手术组比较,*P<0.01; 与脑I/R损伤模型组比较,#P<0.01
组别 TNF-α(pg/ml) IL-6(pg/ml) IL-1β(pg/ml)假手术组 4.51±2.53 34.75±5.83 57.07±25.85脑I/R损伤模型组 73.05±10.24* 114.69±27.02* 398.71±78.99*低剂量给药组 41.41±14.54# 25.45±6.26# 156.59±36.22#高剂量给药组 9.92±7.09# 10.04±2.47# 78.01±36.67#
2.3 各组大鼠皮层脑组织中TLR4 mRNA表达比较 与假手术组比较脑I/R损伤模型组大鼠皮层脑组织中TLR4 mRNA的表达明显升高(P<0.01);
与脑I/R损伤模型组比较,人参皂苷Rg1预处理的大鼠皮层脑组织中TLR4 mRNA的表达随着给药剂量的增加而减少(P<0.01),呈剂量相关。见图1。

图1 各组大鼠皮层脑组织中TLR4 mRNA的表达
2.4 各组大鼠皮层脑组织中TLR4蛋白表达比较 与假手术组比较,脑I/R损伤模型组大鼠皮层脑组织中TLR4蛋白表达较高(P<0.05);
与脑I/R损伤模型组比较,低剂量给药组大鼠皮层脑组织TLR4蛋白的表达降低(P<0.05),而高剂量给药组大鼠皮层脑组织TLR4蛋白的表达显著降低(P<0.01),呈剂量相关。见图2。
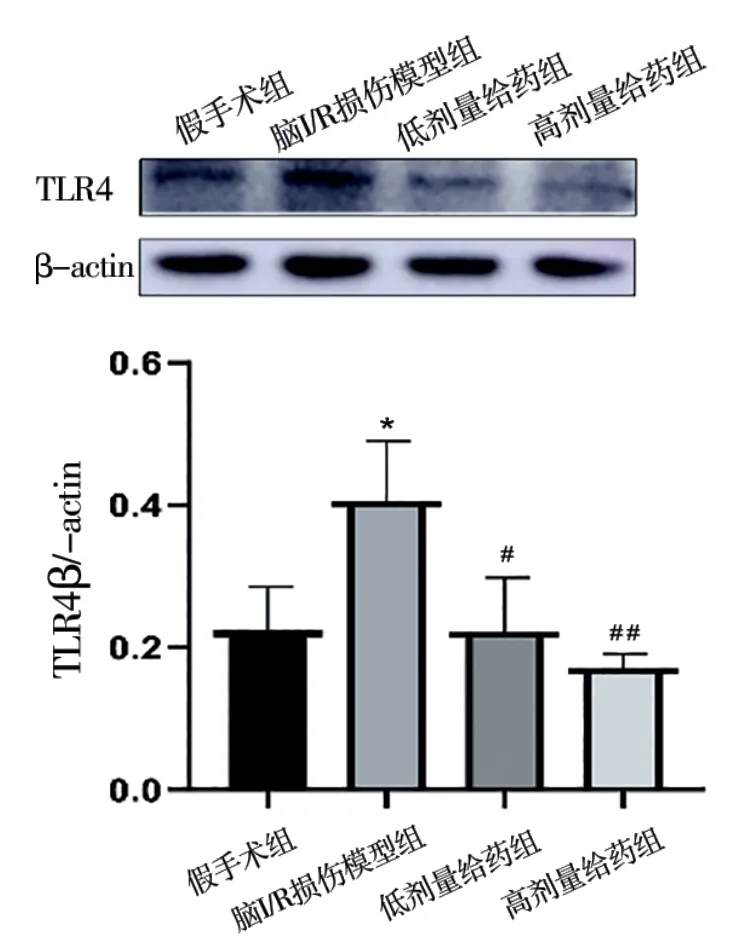
图2 各组大鼠皮层脑组织中TLR4蛋白的表达
2.5 各组大鼠皮层脑组织中TLR4介导的通路蛋白表达比较 与假手术组比较,脑I/R损伤模型组大鼠皮层脑组织中MyD88、NF-κB蛋白的表达增加(P<0.05);
与脑I/R损伤模型组比较,低剂量给药组大鼠皮层脑组织中MyD88、NF-κB蛋白的表达降低(P<0.05),而高剂量给药组大鼠皮层脑组织中MyD88、NF-κB蛋白的表达显著降低(P<0.01),呈剂量相关。见图3。

图3 各组大鼠皮层脑组织中MyD88、NF-κB蛋白的表达
脑I/R损伤是指脑组织缺血一定时间后再恢复血液灌注,使脑组织细胞出现了损伤加重,甚至造成不可逆损伤的现象。近年,中药提取物对脑I/R损伤防治作用的相关报道越来越多[8,9]。其中人参皂苷Rg1是人参的主要活性成分之一,因具有抗氧化、抗凋亡、神经保护等药理学活性而被广泛关注[10]。本实验发现人参皂苷Rg1可以明显降低脑I/R损伤大鼠的运动神经功能缺损评分,这与相关实验结果一致[11],提示人参皂苷Rg1有助于脑I/R损伤大鼠的神经功能恢复。脑I/R损伤病理生理机制复杂,是多种因素共同作用的结果。有研究发现通过诱导自噬,可以增加脑I/R损伤大鼠的脑含水量,减少脑梗死体积,缓解I/R损伤[12];
也有研究发现,通过抑制神经元CA3区细胞内的钙离子,可以保护神经元免受I/R引起的脑损伤[13]。同样,炎症反应也参与脑I/R损伤过程,炎症反应是机体内白细胞和化学因子对抗损伤保护机体的过程,任何作用于机体的损伤都必将引发一系列的炎症反应。当脑I/R损伤发生时,中性粒细胞聚集在毛细血管内皮,同时破坏血脑屏障,引起脑内炎症介质的释放,加重脑损伤。而TLR4是介导脑I/R损伤的关键治疗靶点之一,TLR4是第一个Toll样受体蛋白,可以通过诱导NF-κB控制基因的表达激活适应性免疫[14]。当TLR4激活时,TLR4和MyD88通过促进肿瘤坏死因子受体相关因子6(TRAF6)活化,最终导致NF-κB激活,进而诱导炎症因子的表达和释放,引起组织的进一步损伤[15~17]。TNF-α、IL-1β、IL-6是重要的炎症因子,有研究证明TNF-α、IL-1β、IL-6过度释放会加重脑I/R损伤,阻断TNF-α、IL-1β、IL-6的释放,对脑I/R损伤SD大鼠具有保护作用[18]。本研究中,通过ELISA法检测各组大鼠血浆中TNF-α、IL-6、IL-1β因子的含量发现,人参皂苷Rg1预处理过的大鼠会降低血浆中这三种炎症因子的表达,表明人参皂苷Rg1可以通过抑制炎症因子的释放发挥神经保护作用,而这种保护作用必然会涉及到相关炎症通路的改变。
TLR4/MyD88/NF-κB信号通路是一条重要的调节炎症反应的通路,有研究表明,龙胆苦苷通过抑制TLR4/MyD88/NF-κB信号通路,降低脑I/R损伤后的炎症反应,从而发挥抗脑I/R损伤的作用[19];
雷帕霉素通过抑制TLR4/MyD88/NF-κB信号通路降低脑I/R损伤的炎症反应,抑制脑I/R损伤诱导的神经元凋亡,防止神经元变性[20]。为了验证人参皂苷Rg1是否也能介导TLR4/MyD88/NF-κB信号通路发挥抗脑I/R损伤的作用,我们进行qRTPCR检测各组大鼠皮层脑组织中TLR4 mRNA的表达、Western blot检测大鼠皮层脑组织中TLR4、MyD88、NF-κB蛋白的表达。发现当脑I/R损伤发生时,大鼠皮层脑组织中TLR4 mRNA、蛋白以及MyD88、NF-κB蛋白的表达显著提高,而用人参皂苷Rg1预处理的大鼠皮层脑组织中TLR4 mRNA、蛋白以及MyD88、NF-κB蛋白的表达明显减少,且呈剂量相关,提示当脑I/R损伤发生时,人参皂苷Rg1通过抑制TLR4/MyD88/NF-κB信号通路,抑制TNF-α、IL-1β、IL-6炎症因子的释放,发挥神经保护作用。
综上,人参皂苷Rg1具有良好的抗脑I/R损伤的作用,其机制可能与抑制TLR4介导的MyD88/NF-κB信号通路有关。
猜你喜欢 皮层皂苷脑组织 视皮层神经元结构可塑性研究进展中华实验眼科杂志(2022年6期)2022-11-15三七总皂苷肠溶微丸的含量测定及体外释放度考察中医药导报(2022年6期)2022-11-07纤维素酶法提取无患子皂苷的工艺优化湖北农业科学(2022年16期)2022-09-29电针对慢性社交挫败抑郁模型小鼠行为学及脑组织p11、5-HTR4表达的影响中国中医药信息杂志(2022年6期)2022-06-27D2DR影响运动疲劳后皮层信息输出的作用机制首都体育学院学报(2019年5期)2019-10-18辛伐他汀对高胆固醇血症大鼠APP、BACE蛋白表达的影响中国当代医药(2017年17期)2017-07-25尿激酶对脑组织影响的研究进展中国医药导报(2017年11期)2017-06-01不同宫内缺氧时程对胎鼠脑组织STAT3表达的影响中国民族民间医药·下半月(2015年12期)2016-02-25在线二维柱切换高效液相色谱法同时测定牙膏中三七皂苷R1、人参皂苷Rg1、Re和Rb1分析化学(2014年12期)2014-12-18高原习服黄牛脑组织不同部位SLC25A6 mRNA绝对定量分析江苏农业科学(2014年8期)2014-10-23 相关热词搜索:灌注,通路,人参,






