西方蜜蜂采集蜂上颚腺中高表达基因的筛选与表达分析
时间:2023-02-15 17:50:07 来源:千叶帆 本文已影响人
李秋方, 高 艳, 2, 梁立强, 李正汉卿, 朱雅楠, 张 娟,杨尚宁, 傅云熙, 苏松坤,*, 聂红毅,*
(1. 福建农林大学动物科学学院(蜂学学院), 福州 350002; 2. 江西省养蜂研究所, 江西省蜂业技术推广站, 南昌 330052)
蜜蜂的采集行为对蜂群获得物质与能量、适应环境、生存繁衍以及保护植物多样性等方面具有重要意义(李莉等, 2012),其主要受社会环境、体内激素水平、组织的结构与生理等变化影响(Robinson, 1987; Robinson and Huang, 1998; Whitfieldetal., 2003)。在组织的结构与生理方面,研究者已对蜜蜂脑、咽下腺(hypopharyngeal glands, HGs)、触角等组织中相关基因的差异表达进行了广泛研究,以期阐明采集行为的分子机制。蜜蜂脑是调节蜜蜂学习和记忆等复杂社会行为的中心器官,脑部相关基因的差异表达与采集行为的发育及成熟相关(Hanetal., 2017)。Toma等(2000)研究表明昼夜节律调控基因period的差异表达与蜜蜂的采集行为有关,其在采集蜂的大脑中的表达水平始终显著高于其他日龄蜜蜂,这也暗示了社会性昆虫的劳动分工和生物钟之间在分子水平上存在联系。乙酰胆碱是昆虫大脑中与学习相关的主要神经递质,乙酰胆碱酯酶(AChE)对其具有水解活性,研究发现采集蜂乙酰胆碱酯酶基因mRNA水平的降低导致乙酰胆碱酯酶催化活性显著降低,这在蘑菇体中尤为明显(与嗅觉、视觉学习和记忆有关的大脑区域),而乙酰胆碱酯酶抑制剂美曲磷酯的处理改善了嗅觉学习能力(Shapiraetal., 2001),这些结果证明了采集蜂大脑中乙酰胆碱酯酶基因表达的下调与更高级学习能力的生理需求相一致。Amfor表达水平和相应蛋白活性的增加影响工蜂的行为转变,研究发现该基因在采集蜂视叶薄板中的表达量显著高于哺育蜂,表明该基因可能通过调控视觉通路影响蜜蜂的采集行为(Ben-Shaharetal., 2002),进一步研究发现该基因与采集过程的趋光行为有关(Ben-Shaharetal., 2003)。与哺育蜂相比,采集蜂对蔗糖更敏感,而花粉采集蜂比花蜜采集蜂对蔗糖更敏感。锰影响工蜂的蔗糖反应能力,锰转运体编码基因malvolio(mvl)的表达介导锰向脑细胞中运输(Ben-Shaharetal., 2004)。研究发现,与哺育蜂相比,采集蜂脑中mvlmRNA水平和头部锰含量较高,且花粉采集蜂中的含量高于花蜜采集蜂。锰处理提高了蜜蜂对蔗糖的反应,并导致早熟觅食(Ben-Shaharetal., 2004)。Liu等(2017)研究表明ame-miR-279a可能调节转录因子Mblk-1 进而影响蜜蜂的糖反应能力,最终参与调控蜜蜂的采集行为。工蜂咽下腺的功能存在职能差异:在哺育蜂中合成及分泌蜂王浆,为蜂王、小幼虫提供营养物质;
在采集蜂中,咽下腺分泌蜂王浆蛋白过程受到抑制,转而合成与蜂蜜酿造相关的酶类物质(Ohashietal., 1997; Ohashietal., 1999; Uenoetal., 2015)。Ohashi等(1999)研究发现,α-淀粉酶和葡萄糖氧化酶的编码基因在采集蜂的咽下腺中特异表达,这与采集过程中将花蜜加工成蜂蜜所需的这些碳水化合物代谢酶活性有关。蜜蜂触角上分布着许多复杂的嗅觉感受器,用于检测蜂群中化学信号以及采集过程中的蜜粉源信号。为了揭示工蜂行为发育过程中的嗅觉适应机制,Nie等(2018)通过转录组分析对刚出房蜜蜂、哺育蜂和采集蜂的触角中的基因表达水平进行了全面分析,筛选到14个与采集行为紧密相关的差异表达基因(differentially expressed genes, DEGs),并对不同行为状态下的嗅觉基因家族成员的表达进行了分析,这有助于阐明嗅觉与行为变化之间的分子机制。Mao等(2015)分析了采集蜂触角和足中CYP9Q1,CYP9Q2,CYP9Q3和CYP4G11的表达模式,并表明这4个基因与采集过程有关。
蜜蜂上颚腺(mandibular glands, MGs)是位于蜜蜂头部内表面两侧的一对大型囊状物,作为蜜蜂的重要外分泌腺。在蜂群结构中,上颚腺分泌物的组成与功能存在级型、日龄和职能差异(Huoetal., 2016; Rangeletal., 2016)。工蜂上颚腺主要合成与分泌10-羟基-2癸烯酸(10-hydroxy-2E-decenoic acid, 10-HDA)和10-羟基癸酸(10-hydroxydecanoic acid, 10-HDAA)以及蜂群报警信息素相关的2-庚酮等,在脂质分泌、幼虫营养和信息素合成、劳动分工和蜂群稳定方面至关重要(Barkeretal., 1959; Plettneretal., 1996)。由于基因的多重效应、基因网络的复杂性、环境作用和工蜂劳动分工的可塑性(Robinson, 1992; Robinsonetal., 2005; Behrendsetal., 2007; Hanetal., 2021),研究工蜂上颚腺中基因的表达与调控,对揭示工蜂劳动分工的分子机制有着重要意义。目前,研究者们已从转录组、蛋白质组水平阐释哺育蜂上颚腺在蜂王浆合成与分泌的分子机制(Huoetal., 2016)。然而,采集蜂上颚腺中调控采集行为的机制尚不明确。
本研究利用课题组前期的西方蜜蜂Apismellifera5种不同职能工蜂(3日龄工蜂、10日龄哺育蜂、10日龄采集蜂、21日龄哺育蜂和21日龄采集蜂)上颚腺转录组数据,在降低日龄因素对职能分工影响的基础上,系统分析了5种职能工蜂上颚腺中基因表达模式,筛选了采集蜂上颚腺中高表达的DEGs,并利用qRT-PCR对2个关键DEGs在工蜂不同发育时期和采集蜂不同组织的表达谱进行分析,这些结果将为阐明西方蜜蜂采集行为的分子机制奠定基础。
1.1 实验蜂种
实验材料为福建农林大学动物科学学院(蜂学学院)实验蜂场的“蜂强1号”西方蜜蜂。蜂群由课题组进行饲养管理以确保能维持强群,群内至少含有健康饱满的临出房的封盖子脾2~3张(平均温度约为25℃,相对湿度为60%~65%,光周期为13L∶11D)。
1.2 主要试剂及仪器
荧光定量PCR仪(美国Bio-Rad公司)、体视显微镜1台、冷光源1台;
RNA提取液、Hiscript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)(Vazyme公司,南京)、ChamQ Universal SYBR qPCR Master Mix(Vazyme公司,南京)。
1.3 上颚腺转录组学分析及采集蜂上颚腺高表达DEGs筛选
3日龄工蜂(3 dW)、10日龄哺育蜂(10 dN)、21日龄哺育蜂(21 dN)、10日龄采集蜂(10 dF)和21日龄采集蜂(21 dF)的Illumina转录组测序数据(每个样本3个生物学重复)来源于本课题组前期公布数据(NCBI SRA登录号: SUB8031156)。基于FPKM(fragments per kilobase of exon model per million mapped fragments)计算基因表达量,并分析和筛选DEGs (高艳等, 2020)。采集蜂上颚腺中高表达DEGs的筛选标准如下:DEGs在21 dF上颚腺中的表达量显著高于3 dW, 10 dN和21 dN上颚腺中的;
DEGs在10 dF上颚腺中的表达量显著高于10 dN上颚腺中的;
DEGs在21 dF上颚腺中表达量与10 dF上颚腺中的无显著差异。利用clusterProfiler R软件包、GO数据库、KEGG数据库、BLAST软件,并结合NovoMagic平台对DEGs进行GO和KEGG富集分析。
1.4 qRT-PCR检测DEGs的表达量
基于梁立强等(2021)限王产卵的方法,准确收集西方蜜蜂3日龄卵、1日龄幼虫、3日龄幼虫、5日龄幼虫、1日龄蛹、3日龄蛹、5日龄蛹、7日龄蛹、9日龄蛹、11日龄蛹、刚出房工蜂。将封盖子脾置于35℃的培养箱,收集出房时间小于6 h的工蜂作为刚出房蜜蜂;
收集头部插入幼虫巢房持续10 s以上的工蜂作为哺育蜂;
收集返回巢门口且花粉筐载有花粉的工蜂作为采集蜂。按照高艳等(2021)组建蜂群方法,采集10日龄哺育蜂和10日龄采集蜂,在干冰上分别解剖采集蜂的上颚腺、咽下腺、脑、胸、腹、足、翅和触角以及10日龄哺育蜂和10日龄采集蜂的上颚腺,采用Trizol法提取RNA,利用Hiscript®Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)(Vazyme公司,南京)合成用于qRT-PCR分析的cDNA。
从采集蜂上颚腺中特异性上调表达DEGs中随机选择了8个基因(LOC100576395,LOC411983,LOC410235,LOC725581,LOC410527,LOC406131,LOC408453和LOC410253),利用qRT-PCR检测在10日龄哺育蜂和10日龄采集蜂上颚腺中表达量;
同时利用qRT-PCR检测本研究筛选到的2个可能与采集蜂能量代谢和外源性物质解毒相关的关键DEGs [Δ-1-吡咯啉-5-羧酸合成酶基因Amp5cs(LOC412948)和细胞色素P450 9e2基因CYP9Q3(LOC408453)]在不同发育时期和采集蜂各组织(上颚腺、咽下腺、脑、胸、腹、足、翅和触角)中的表达量。
利用Primer Premier 6软件设计基因特异引物(表1),以actin(GenBank登录号: NM_001185146.1)作为相对定量的内参基因。PCR反应体系(10 μL): ChamQ Universal SYBR qPCR Master Mix(Vazyme公司,南京)5 μL, 正反向引物(10 μmol/L)各0.4 μL, cDNA模板1 μL, ddH2O 3.2 μL。PCR反应条件: 95℃预变性3 min; 95℃变性10 s, 60℃退火 30 s, 40次循环; 最后溶解曲线分析。每组设置3个技术重复和3个生物学重复(3日龄卵和1日龄幼虫每组100个个体,其他发育时期每组3个个体,组织样本每组20个个体)。采用2-ΔΔCt法计算DEGs的相对表达量(Livak and Schmittgen, 2001)。
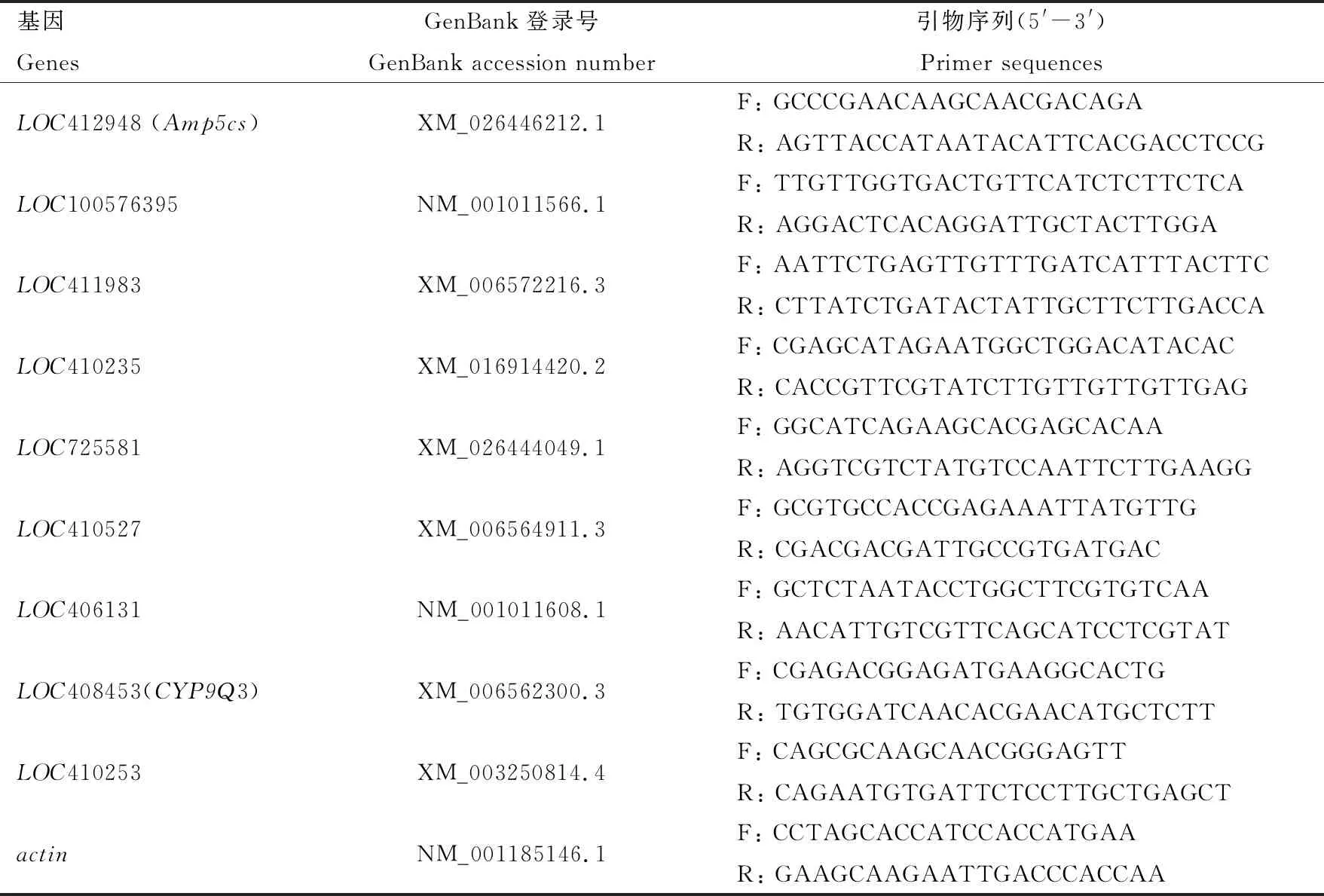
表1 引物信息
1.5 数据分析
Graphpad Prism Version 8用于图表绘制,其中转录组数据可靠性验证时,基因表达量采用独立样本T检验进行显著性分析;
目的基因时空表达采用单因素方差分析(one-way ANOVA)方法进行显著性分析。
2.1 采集蜂上颚腺中高表达DEGs
基于上颚腺转录组数据筛选到21 dFvs3 dW有2 770个DEGs;
21 dFvs10 dN有568个DEGs;
21 dFvs21 dN 有664个DEGs;
10 dFvs10 dN有374个DEGs,将这4组交集得到69个共有DEGs。这69个DEGs可能与采集行为调控及日龄发育等相关。由于工蜂劳动分工的可塑性,我们排除21 dFvs10 dF与69个DEGs交集得到的7个DEGs以减少日龄因素的干扰,最终得到采集蜂上颚腺中高表达的62个DEGs(图1)。

图1 西方蜜蜂工蜂上颚腺(MG)中高表达基因筛选韦恩图
在62个DEGs中,只有22个DEGs在21日龄采集蜂上颚腺中的表达量显著高于在3日龄工蜂、10日龄哺育蜂、21日龄哺育蜂上颚腺中的表达量,同时这些基因在10日龄采集蜂上颚腺中的表达量也显著高于在10日龄哺育蜂上颚腺中的表达量,符合筛选采集蜂上颚腺中高表达DEGs的标准(表2);
而另外35个DEGs则呈现相反的趋势,即在同日龄(21和10日龄)采集蜂上颚腺中的表达量均低于相应日龄哺育蜂上颚腺中的表达量,同时在21日龄采集蜂上颚腺中的表达量也显著低于在3日龄工蜂和10日龄哺育蜂上颚腺中的表达量。
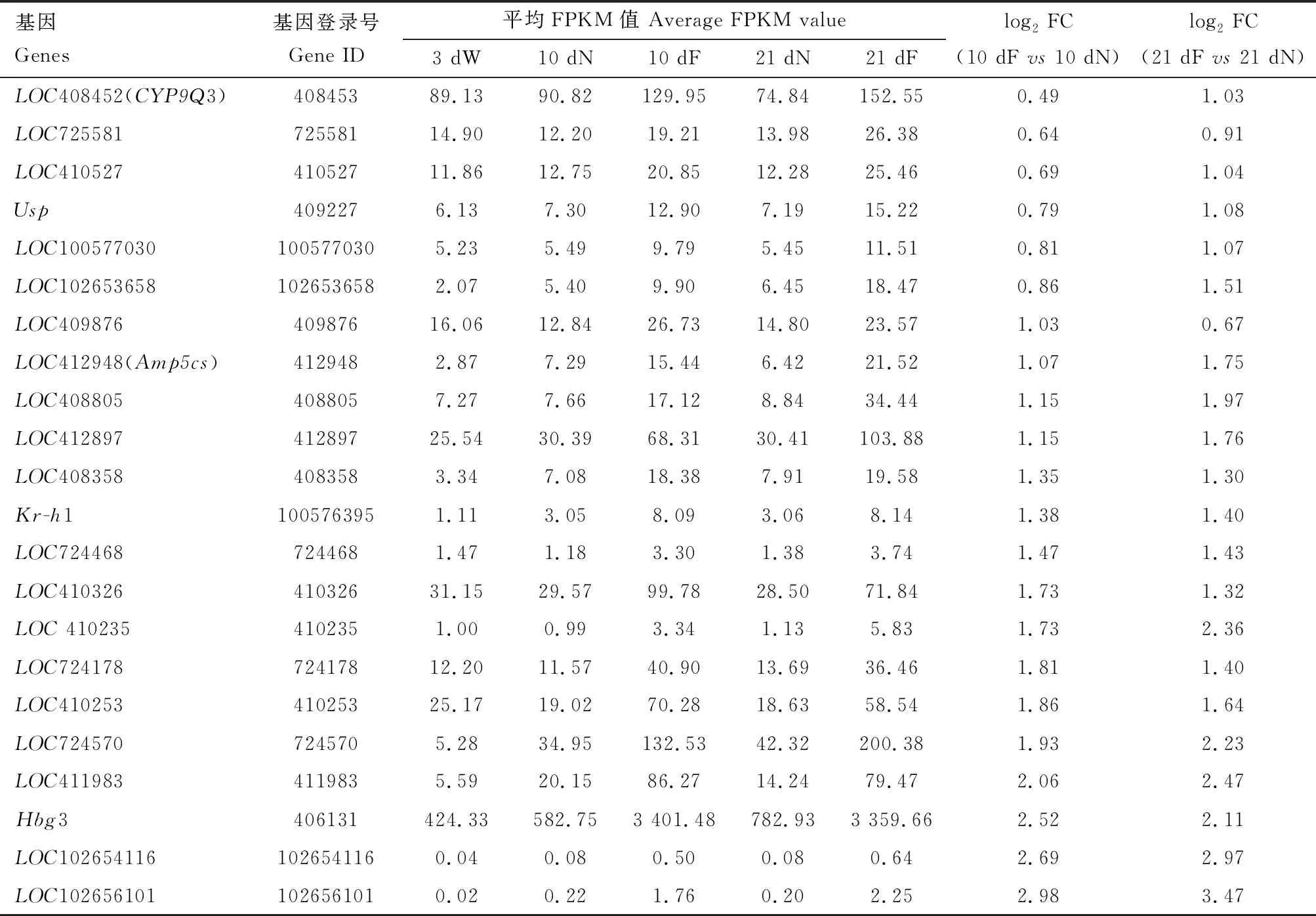
表2 西方蜜蜂工蜂上颚腺中22个上调差异表达基因(DEGs)的表达
2.2 采集蜂上颚腺中高表达DEGs功能富集
22个上调表达DEGs的GO功能富集表明:在细胞组成大类中,DEGs富集在细胞核(nucleus)、细胞内膜结合细胞器(intracellular membrane-bounded organelle)、膜结合细胞器(membrane-bounded organelle);
在分子功能大类中,DEGs主要富集在氧化还原酶活性(oxidoreductase activity)、过渡金属离子结合(transition metal ion binding)、序列特异性DNA结合转录因子活性(transcription factor activity, sequence-specific DNA binding)、核酸结合转录因子活性(nucleic acid binding transcription factor activity)、四吡咯结合(tetrapyrrole binding)、血红素结合(heme binding)、阴离子跨膜转运蛋白活性(anion transmembrane transporter activity)、铁离子结合(iron ion binding)等;
在生物学过程大类中,DEGs主要富集在激素应答(response to hormone)、激素介导的信号通路(hormone-mediated signaling pathway)、脂质应答(response to lipid)、甾体激素介导的信号传导(steroid hormone-mediated signaling pathway)等(图2)。KEGG通路富集表明,DEGs主要富集在胆固醇代谢(cholesterol metabolism)、半乳糖代谢(galactose metabolism)、淀粉和蔗糖代谢(starch and sucrose metabolism)、精氨酸和脯氨酸代谢(arginine and proline metabolism)、细胞凋亡-果蝇(apoptosis-fly)、氨基酸生物合成(biosynthesis of amino acids)、过氧化物酶体(peroxisome)、自我吞噬-动物(autophagy-animal)等通路(图3)。
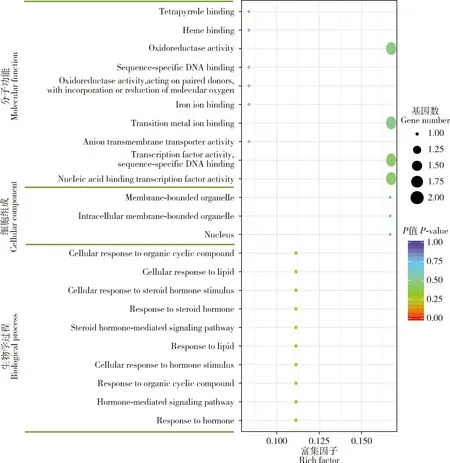
图2 西方蜜蜂工蜂上颚腺中22个上调的差异表达基因(DEGs)的GO功能富集
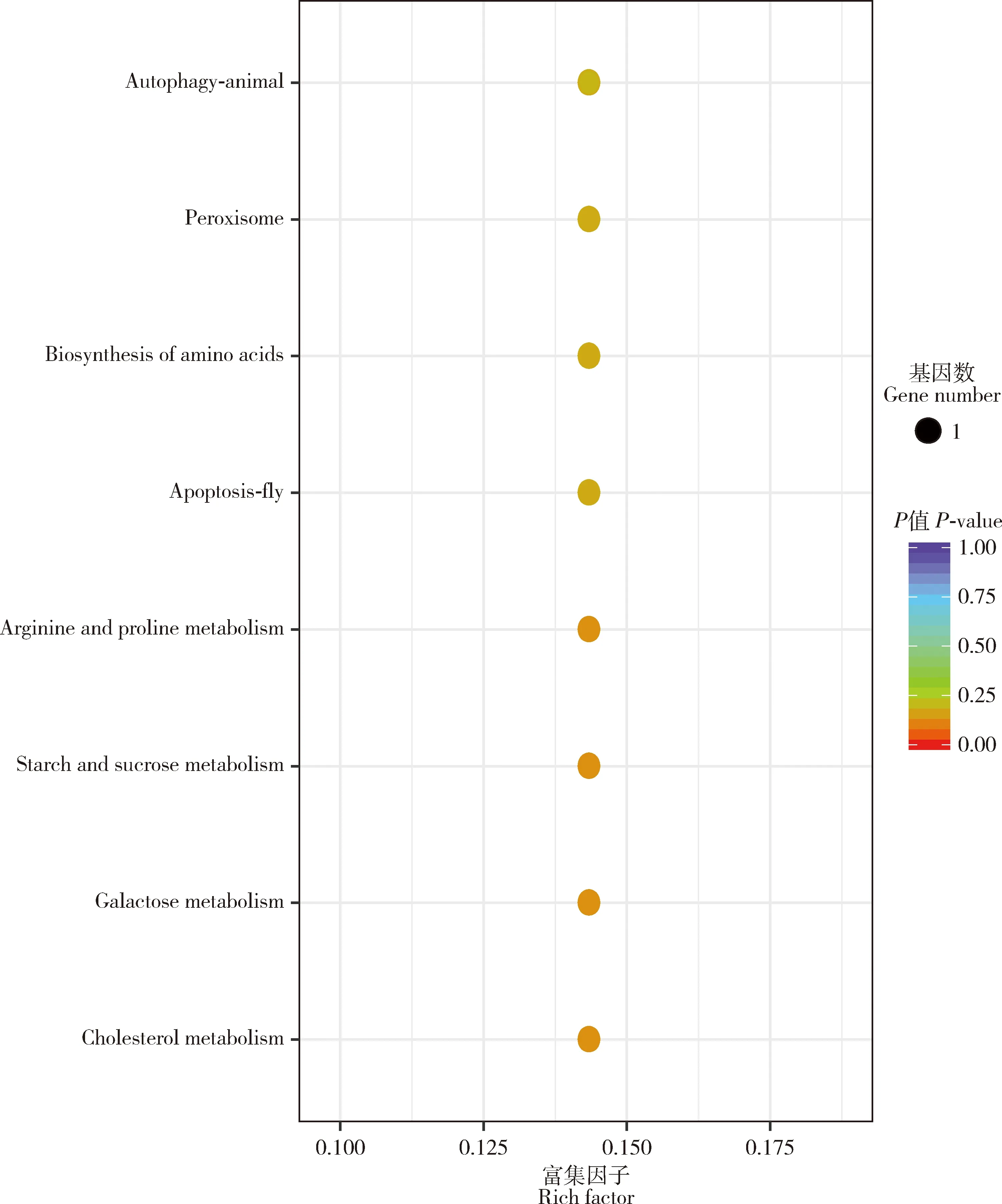
图3 西方蜜蜂工蜂上颚腺中22个上调的差异表达基因(DEGs)的KEGG通路富集
2.3 转录组数据的可靠性验证
对qRT-PCR结果表明:随机选择的8个DEGs(LOC100576395,LOC411983,LOC410235,LOC725581,LOC410527,LOC406131,LOC408453和LOC410253)的表达模式与转录组数据的表达模式一致(图4),进一步证实了上颚腺转录组数据的可靠性。
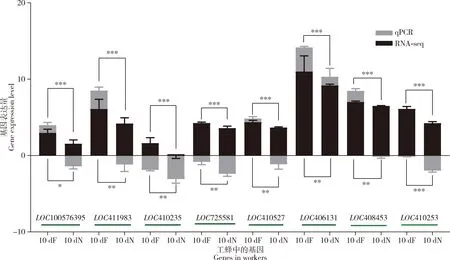
图4 西方蜜蜂工蜂上颚腺中8个差异表达基因(DEGs)的qRT-PCR验证
2.4 关键DEGs时空表达
LOC412948(Amp5cs)在西方蜜蜂工蜂各发育阶段均有表达(图5: A),其在卵期表达量较低;
在幼虫阶段表达量相对较高;
在蛹期表达量有两个上升阶段,在1-5日龄时表达量逐渐升高,且在5日龄蛹达到蛹期峰值,随着日龄的发育在7日龄蛹的表达量陡然下降,然后逐步上升;
在从刚出房蜜蜂到采集蜂的表达量呈上升趋势,且在采集蜂中的表达量达到整个发育历程的最大值。LOC408453(CYP9Q3)在西方蜜蜂各发育阶段中均有表达(图5: B),在卵期相对表达量较低;
幼虫阶段表达量在5 日龄时较高,而其他日龄时较低;
在蛹期的表达量更低且表达趋势较稳定;
在成年蜂阶段随着日龄的发育表达量呈高量表达的上升趋势。整个发育历程中,该基因在采集蜂中的表达量高于其他发育阶段的表达量。
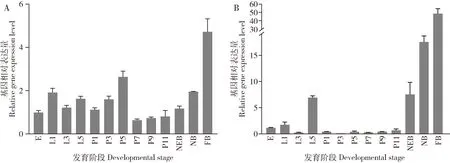
图5 西方蜜蜂工蜂上颚腺中差异表达基因(DEGs)LOC412948(Amp5cs)(A)和LOC408453(CYP9Q3)(B)在各发育阶段的相对表达量
LOC412948(Amp5cs)在采集蜂各检测组织中均有表达,但在腹、胸、上颚腺和触角中的表达量显著高于在其他组织中的表达量(P<0.05)(图6: A)。LOC408453(CYP9Q3)在采集蜂各检测组织中均有表达,在触角和足中的表达量显著高于在其他组织中的(P<0.05)(图6: B)。
3.1 主要富集通路中相关DEGs
本研究在采集蜂上颚腺中共筛选到22个高表达的DEGs,这些DEGs主要富集在胆固醇代谢、半乳糖代谢、淀粉和蔗糖代谢、精氨酸和脯氨酸代谢、细胞凋亡-果蝇、氨基酸生物合成、过氧化物酶体、自我吞噬-动物等代谢通路(图2, 3),表明DEGs可能主要参与采集蜂上颚腺生理发育以及能量供应、外源性物质解毒、花蜜转化等代谢通路,进而影响蜜蜂的采集行为。
在昆虫生长发育过程中,脂类物质起到至关重要的作用:昆虫体内贮存的脂肪为胚胎发生和发育、变态、昆虫飞翔和生殖提供能源,脂类物质也是昆虫激素和信息素等的组成成分(李晓凤等, 2020)。泛素-蛋白酶体系统是一种真核生物中广泛存在的蛋白质降解通路,在细胞增殖、细胞分化、细胞凋亡和DNA修复、细胞免疫与应答等生理活动中起着重要调控作用,E3 泛素连接酶作为泛素-蛋白酶体系统的重要组成部分,在蛋白泛素化过程中决定底物识别的特异性(金姝雯等, 2021)。本研究转录组数据分析发现,E3 泛素连接酶编码基因LOC412897在采集蜂上颚腺特异性高表达(表2),且KEGG富集分析显示该基因富集在胆固醇代谢通路中,推测其可能在采集蜂上颚腺脂类物质代谢和蛋白质降解等生理过程中承担着更加复杂的功能。
超气门蛋白(ultraspiracle, USP)是核激素受体家族的成员,该家族是调控细胞分化和发育、稳态及生殖的配体激活的转录因子,在胚胎和胚胎后发育中起着关键作用(Segraves, 1991)。
在果蝇Drosophila中,两种活性JH亚型生理调节因子(JH酸和JH甲酯)与USP特异结合,诱导了USP的构象变化和寡聚,这可能赋予USP不同的活性来影响转录过程(Jones and Sharp, 1997)。USP和蜕皮激素受体(EcR)形成的异源二聚体与蜕皮激素结合后,调控昆虫生理的许多方面。本研究转录组分析发现编码USP的基因LOC409227在采集蜂上颚腺中高量表达(表2),其可能是蜜蜂MGs对JH和蜕皮激素作出应答的媒介,促进采集蜂的行为发育与成熟。
Kruppel同源物(Kruppel homologs, Kr-hs)是锌指转录因子,在协调发育和细胞分化中起重要作用,包括神经发育(Isshikietal., 2001; Kaczynskietal., 2003)。研究表明Kruppel homolog 1(Kr-h1)在果蝇形态发生过程中对蜕皮激素具有敏感性,并与果蝇幼虫的运动轴突引导和突触发生有关(Pecasseetal., 2000; Krautetal., 2001)。另外,在不同物种的进化过程中,这个家族的成员经历了复制并获得了新功能(Shannonetal., 2003)。在蜜蜂中,微阵列研究表明,与哺育蜂相比,采集蜂脑部Kr-h1有着更高的表达量(Whitfieldetal., 2003),其表达受蜂王上颚腺信息素的强烈调控,特别是在蜜蜂脑部综合感觉信息的蘑菇体中(Grozingeretal., 2003)。进一步研究表明Kr-h1表达与采集状态无关,而是与行为转变的稳定生理变化有关(Fussnecker and Grozinger, 2008),例如基因表达和神经元结构变化,这些变化是将上颚腺信息素刺激传递给下游行为和生理变化所必需的。本研究发现Kr-h1的编码基因LOC100576395在采集蜂上颚腺中的表达量显著性高于在哺育蜂中的(表2),暗示转录因子Kr-h1在采集蜂上颚腺中具有其他功能,可能参与采集蜂上颚腺的信息素处理及其他相关代谢过程。
碳水化合物代谢酶中的α-葡萄糖苷酶(α-glucosidases,HBGases)在将花蜜中的蔗糖转化为葡萄糖、果糖的过程中起着重要的作用(Chanchaoetal., 2008)。根据底物特异性,HBGases有3种异构体:HBGaseⅠ, HBGaseⅡ和HBGaseⅢ(Kubotaetal., 2004)。其中,野生型HBGaseⅢ以蔗糖为底物。研究表明,工蜂的上颚腺与咽下腺存在两种截然不同的职能状态(Kuboetal., 1996):哺育蜂的上颚腺和下咽腺发育良好有助于合成与分泌蜂王浆,而采集蜂的上颚腺和咽下腺萎缩退化,并激活将花蜜中蔗糖水解为葡萄糖和果糖的α-糖葡萄糖苷酶。本研究发现编码HBGaseⅢ的基因LOC406131在采集蜂上颚腺中的表达量显著高于哺育蜂中的(表2),这与采集蜂在采集过程中将花蜜中的蔗糖水解为葡萄糖和果糖的水解活性需求有关(Simpsonetal., 1968; Sasagawaetal., 1989),表明该基因可能在采集蜂上颚腺促使花蜜中的蔗糖水解为葡萄糖和果糖的过程中发挥着重要的作用。
蜜蜂的信息素成分具有显著的复杂性,这些化学信号是碳氢化合物、蜡酯、脂肪酸、醛和醇的混合物。Teerawanichpan等(2010)研究表明,在蜜蜂中脂肪酰辅酶A还原酶(AmFAR1)催化多种脂肪酸转化为相应的醇。其中,AmFAR1在蜜蜂头部高表达,异源表达表明AmFAR1可以将多种脂肪酸转化为相应的醇,其中C18硬脂酸是最佳的底物。此外,疏水图谱分析表明AmFAR1在其羧基末端含有一个高度疏水区域,在哺乳动物中也观察到了疏水区,这是将酶靶向合成血浆原的过氧化物酶体所必需的(Cheng and Russell, 2004; Honshoetal., 2010)。结合AmFAR1的一级结构、底物谱以及在工蜂中的表达模式,表明AmFAR1不太可能在分泌蜂蜡方面起主要作用,而是合成脂肪醇参与信息素的生物合成。本研究转录组数据分析表明,脂肪酰辅酶A还原酶的编码基因(LOC411983)在采集蜂上颚腺中显著高表达(表2),其编码产物可能与采集过程中复杂的信息交流有关。
3.2 采集蜂脯氨酸合成相关DEGs
本研究转录组测序比较结果表明,与采集行为紧密相关的Amp5cs富集在精氨酸和脯氨酸的代谢通路中。qRT-PCR结果表明,Amp5cs在成年蜂中的表达量随日龄增长而增加,在采集蜂中表达量达到峰值(图5: A);
在采集蜂各组织中,Amp5cs在腹、胸、上颚腺和触角中高量表达(图6: A)。而在前期相关研究中,Micheu等(2000)发现与喂食葡萄糖并保持休息状态的采集蜂相比,喂食或注射葡萄糖的采集蜂在完成飞行实验后,血淋巴中脯氨酸的浓度显著降低,但其他氨基酸的含量没有显著性变化,这表明脯氨酸参与采集蜂的飞行代谢;
Carter等(2006)研究表明,花蜜中的脯氨酸主要为蜜蜂短期、快速的采集飞行提供能量,而葡萄糖用于长期的飞行代谢;
Mollaei等(2013)研究表明,脯氨酸能显著降低蜜蜂的过冷却点(supercooling point, SCP),进而提高蜜蜂的耐寒性。另外,在马铃薯甲虫Leptinotarsadecemlineata中,RNAi沉默Amp5cs,结果显著降低了成虫血淋巴中脯氨酸和精氨酸含量,进一步降低了飞行速度,缩短飞行距离,并增加了成虫的死亡率(Wanetal., 2014)。综上表明,Amp5cs可能参与蜜蜂中Pro和Arg的生物合成,为采集过程及相关组织发育提供能量,而Amp5cs基因在上颚腺中高量表达,可能与采集蜂上颚腺的生理发育有关。
3.3 采集蜂外源性物质降解相关DEGs
本研究中,qRT-PCR检测比较了CYP9Q3编码基因(LOC408453)在不同发育时期和采集蜂不同组织间的表达模式。结果显示,该基因的表达量在成蜂阶段随日龄增长而增加,采集蜂中表达量达到最高(图5: B),而在采集蜂不同组织间,在触角和足中显著性高量表达(图6: B),这与前期研究结果(Maoetal., 2011, 2015)一致,表明细胞色素P4509e2基因可能也参与采集过程中复杂的外源物质的解毒。另外,在减少日龄因素干扰下,相比3日龄工蜂和哺育蜂,该基因在采集蜂上颚腺中显著高表达,表明该基因在采集蜂上颚腺中具有其他功能,可能与上颚腺相关生理变化有关。
蜂群的劳动分工受复杂多样的因子网络调控,包括蜜蜂脑部、咽下腺、上颚腺等相关组织中基因的综合性调控。基于蜂群劳动分工的可塑性,在减少日龄因素影响下,深入分析3 日龄幼蜂、相同日龄哺育蜂和采集蜂(10和21日龄)上颚腺转录组数据,筛选出22个采集蜂上颚腺中高表达的DEGs,其中2个关键的DEGs(Amp5cs和P4509e2)在采集蜂和采集蜂上颚腺组织高量表达,暗示它们可能在采集行为中发挥重要的生理功能,后续可利用RNAi或CRISPR/Cas9技术验证其功能。该研究对上颚腺中基因表达模式进行系统分析,为上颚腺调控采集行为的分子机制及相关基因功能研究奠定基础。
猜你喜欢 工蜂哺育日龄 初配日龄对杜洛克母猪繁殖性能的影响中国猪业(2022年4期)2022-09-20造房前的准备第二课堂(课外活动版)(2022年5期)2022-05-25初配日龄对丹系母猪产仔性能的影响养猪(2022年2期)2022-04-25小保姆成长记第二课堂(课外活动版)(2022年1期)2022-04-23勤劳的工蜂第二课堂(课外活动版)(2021年12期)2021-01-18初夏东坡赤壁诗词(2020年5期)2020-11-06母亲哺育我 我报慈母恩海峡姐妹(2020年10期)2020-10-28母亲哺育我 我报慈母恩海峡姐妹(2020年4期)2020-05-30电脑“工蜂”第一财经(2019年8期)2019-08-26不同去势日龄对保育猪生长性能的影响国外畜牧学·猪与禽(2018年11期)2018-05-14 相关热词搜索:上颚,表达,蜜蜂,






