构建负载siNLRP3的超声响应纳米系统并评估其对糖尿心肌病的治疗作用
时间:2023-02-19 14:55:06 来源:千叶帆 本文已影响人
肖雯婧 ,侯 君 ,张再媛 ,王婷婷 ,呼永河,
(1.西南交通大学材料科学与工程学院,四川成都 610031;2.中国人民解放军西部战区总医院药剂科,四川成都 610083;3.西南交通大学医学院,四川成都 610031)
糖尿病已成为影响中国人健康的主要慢性病之一[1],糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种独立于高血压、冠心病及其他已知心脏疾病,由糖代谢紊乱引起的严重心脏并发症[2]。DCM 的发病机制复杂,其中体内高糖环境可导致心细胞活性氧(reactive oxygen,ROS)增多,促进核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)过度激活,这可能是其重要发病原因之一[3]。NLRP3激活是细胞焦亡起始因素,既往研究显示,沉默NLRP3可有效抑制细胞焦亡,改善DCM症状,保护心功能[4-5]。然而,心脏组织致密,如何将基因药物有效递送至心脏是研究靶向NLRP3治疗DCM 临床转化价值的关键突破点。与传统病毒载体相比,超声靶向微泡爆破技术(ultrasound targeted microbubble destruction,UTMD)作为体外刺激,可远程调控基因物质定点释放,因其安全、无创、低成本等优势备受关注。超声成像是一种成熟的心血管疾病临床诊断法,而通过UTMD 介导超声响应微泡向心脏靶向递送基因药物是一种有前景的心血管疾病治疗新手段[6]。但传统UTMD 多使用微泡(microbubbles,MBs)作为基因载体,受限于微米级尺寸,即使在具有高通透性和滞留效应(enhanced permeability and retention effect,EPR 效应)的肿瘤组织,MBs仍然很难穿过血管内皮间隙进入肿瘤内部,从而有效递送药物[7]。心脏组织间隙比肿瘤更加致密,其生理屏障严重阻碍MBs介导的药物递送,因此,研究具有更强组织穿透能力的超声响应纳米载体系统对促进心脏基因治疗临床转化具有重要价值。本研究首先合成一种生物安全性好的嵌段共聚物与siNLRP3形成胶束,增加载体对基因药物的装载量,随后将胶束与气芯脂质体异组装形成超声响应纳米载体系统,增强其穿透能力,研究其对DCM 的治疗作用。
1.1 材料
甲氧基-聚乙二醇-氨基(m PEG2000-NH2)、N-ε-苄氧羰基赖氨酸酸酐(CBLLys-NCA)、二棕榈酰基磷脂酰乙醇胺(DPPE)、二棕榈酰磷脂酰胆碱(DPPC)及二硬脂酰基磷脂酰乙醇胺(DSPE)均购于Sigma-Aldrich公司;siNLRP3(NLRP3 小干扰RNA)由北京擎科生物科技有限公司合成;链脲佐菌素、HE 试剂盒、Masson试剂盒购于成都湖畔科技有限公司;雄性SPF级SD 大鼠、普通饲料、高脂饲料购于成都达硕实验动物有限公司,动物准字为SCXK(川)2020-030,动物实验方案参照中国动物福利法案设计,申请后经中国人民解放军西部战区总医院伦理委员会审批通过后进行;抗NLRP3抗体(Cat#MA5-32255,1∶600稀释)、抗caspase-1-p20抗体(Cat#PA5-99390,1∶600稀释)、抗IL-1β抗体(Cat#PA5-46956,1∶200稀释)购于Santa Cruz公司,抗GSDMD-N 抗体(Cat#A20728,1∶600稀释)购于爱博泰克生物公司,合成mPEG-b-PLLys并制备siNLRP3胶束。
参照文献[8]以端氨基聚乙二醇(m PEG)作为大分子引发剂,采用开环聚合方式合成mPEG-b-PLLs。合成路线(图1A)如下:Schlenk 瓶中加入mPEGn-NH2(Mn=2 000 Da)与CBLLys-NCA 单体(摩尔比为1∶55),加入无水二甲基亚砜20 m L,35℃氮气保护反应72 h。反应结束后将产物沉淀到大量冷乙醚中,抽滤,不溶物减压干燥,即得白色共聚物mPEG-b-PCBLLys。mPEG-b-PCBLLys 溶解于0℃的三氟乙酸,随后加入33%溴化氢醋酸溶液。室温搅拌反应2 h,加入过量乙醚,用乙醚反复洗涤5次。低速离心去掉过量溶剂,减压干燥获得mPEG-b-PLLs。共聚物采用1H NMR(Bruker AM 300,德国BRUKER 公司)表征产物结构确定苄基完全脱离并使用凝胶渗透色谱(Waters 2695,美国WATERS公司)检测分子量。随后按N/P比1∶4采用自组装方式制备siNLRP3-mPEG-b-PLLys胶束。
1.2 方法
1.2.1 制备负载siNLRP3的纳米载体系统 首先采用薄膜水化超声法制备超声响应纳米微泡:精密称取处方量DPPE∶DPPC∶DSPE(摩尔比1∶1∶0.1)置于茄形瓶中,加入氯仿使其完全溶解形成澄清透明溶液,使用旋转蒸发仪(R-200,瑞士BUCHI公司),37℃水浴真空蒸发磷脂溶液得脂质体膜,然后放入真空干燥箱,25℃常温真空干燥除去残留有机溶剂。干燥12 h 后取出茄形瓶加入水化介质(含体积比10%甘油以及2 mg/m L 泊洛沙姆F-68),50℃水化脂质体膜60 min,震荡形成囊泡。将囊泡悬浮液转移至50 m L 无核酶离心管中,用50 m L 带细长针的注射器将液体上方的空气替换为C3F8气体,然后将该囊泡溶液于55℃水浴超声(200 W,5 min)形成粒度较为均匀的气芯脂质体。气芯脂质体与siNLRP3胶束按照siRNA 含磷量/气芯脂质体磷量比1∶6混合,25℃孵育30 min,形成siNLRP3异组装纳米体系(siNLRP3-NBs)。使用动态光散射法(dynamic light scattering method,DLS,NanoZS90,英国马尔文公司)检测siNLRP3-NBs粒度及Zeta电位。
1.2.2 检测NBs对siNLRP3 的保护作用 使用RNase ONE(TM)Ribonuclease检测NBs保护siNLRP3不被RNA 酶降解的作用。按siRNA 量计算,分别取0.5μg siNLRP3或0.5μg siNLRP3与NBs混合加入1.5 mL无核酸酶的EP管中,加入含0.1 unit核糖核酸酶的反应缓冲液(含10 mmol/L p H 7.5的Tris-HCl缓冲液,5 mmol/L EDTA 和0.2 M 乙酸钠)。另取0.5μg未进行酶解siNLRP3作为对照组,37℃孵育60 min后加入10μg肝素继续室温孵育60 min,然后进行琼脂糖凝胶电泳观察NBs对siNLRP3的保护作用。
1.2.3 实验动物及模型 SD大鼠[(200±20)g,雄性]随机分为4组:对照组(CON)、糖尿病心肌病组(DCM)、糖尿病心肌病siNLRP3-NBs治疗组(US-)、糖尿病心肌病siNLRP3-NBs联合UTMD 治疗组(US+)。除CON组外,其余组大鼠使用高脂饲料喂养(含16%脂肪,0.25%胆固醇)进行喂养,4周后按35 mg/kg腹腔注射链脲霉素(streptozotocin,STZ)。STZ注射1周后检测大鼠空腹血糖,空腹血糖≥16.7 mol/L确定造模成功,每组8只随机分入DCM 组或治疗组。
1.2.4 药物及超声辐照处理 喂养8周后,DCM 组尾静脉注射治疗组等体积生理盐水。US-组按200μg/kg每3 d经尾静脉注射siNLRP-NBs。US+组麻醉后呈仰卧位置于37℃加热垫上,注射US-组等剂量siNLRP-NBs后胸部备皮行心脏超声(Acuson Sequoia 512C 彩色多普勒超声诊断系统,德国Siemens公司),探头置于心前区取左心室乳头肌短轴观(深度约4.0 cm),经尾静脉注射药物,心肌内观察到纳泡后超声调节至微泡爆破模式以击破微泡(MI=1.9),超声爆破至纳泡完全消失。疗程共4周,每周定时监测大鼠体质量及空腹血糖。
1.2.5 大鼠超声心功能检查 疗程结束后检测各组大鼠心功能变化程度。使用100 g/L 水合氯醛麻醉大鼠后取超声心动图像,并取心功能参数,参数包括左室短轴缩短率(LVFS)、左室收缩末期压力(LVESP)、左室舒张末期压力(LVEDP)。
1.2.6 检测心肌纤维化程度 疗程结束后处死大鼠,取左心室进行石蜡包埋。切片后按照试剂盒说明书进行Masson染色及HE 染色并计算心肌胶原容积分数(collagen volume fraction,CVF)。
1.2.7 检测心肌NLRP3 相关蛋白表达 使用Western blotting法检测NLRP3蛋白表达量及焦亡相关指标caspase-1、IL-1β、GSDMD-N 在心肌组织中表达改变情况。
1.3 统计学处理
使用SPSS v18.0(SPSS,Chicago,IL,USA)分析实验数据,数据以均数±标准差表示。本实验数据符合正态分布,两组数据选择独立样本t检验,多组数据使用单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
2.1 mPEG-b-PLLys及siNLRP3-NBs表征
图1B 为mPEG-b-PLLys的1H NMR 图谱,化合物中特征氢质子吸收峰均有所标示,图谱中未见苄基氢相关位移,提示mPEG-b-PCBLLys苄基完全脱去转化为mPEG-b-PLLys。表1为通过1H NMR 及GPC测量得到的共聚物分子量,结果表明,该共聚物具有较好的分子量和较窄的多分散性。图1C为siNLRP3与核酸酶共孵育后电泳图,siNLRP3异组装入NBs后可有效避免被核酸酶降解,泳道内未发现裸siNLRP3,而siNLRP3-NBs泳道内可观察到明显条带,提示其结构未发生改变,纳米体系可有效保护siNLRP3核酸酶环境下的结构完整性。图1D 为siNLRP3 胶束及siNLRP3-NBs透射电镜图,粒度与DLS结果基本一致,siNLRP3-NBs中观察到NBs表面隐约可见磷脂膜,囊泡内颗粒可能为siNLRP3胶束。表2为siNLRP3胶束及siNLRP3-NBs的粒度与Zeta电位。
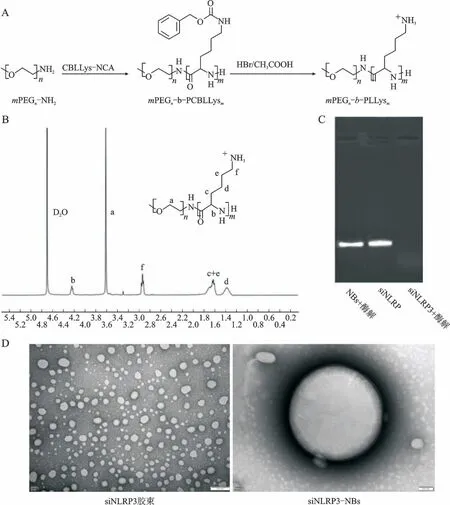
图1 共聚物及NBs表征图Fig.1 Characterization of copolymer and NBs

表1 共聚物分子量Tab.1 Molecular characteristics of the synthesized block copolymers

表2 胶束及NBs粒径及Zeta电位分布Tab.2 Mean diameter and zeta potential of micelle and NBs
2.2 UTMD增强siNLRP3对DCM 大鼠心功能的改善作用
超声心动图结果(图2)显示,与CON 组相比,DCM 组大鼠LVFS与LVESP明显下降[(LVFS:(52.8±2.3)%vs.(32.0±1.9)%,P<0.05;LVESP:(98.3±7.4)mm Hgvs.(58.4±3.2)mm Hg,P<0.05)],LVEDP明显上升[(2.93±0.41)mmHgvs.(4.12±0.62)mmHg,P<0.05)],提示大鼠左心室腔增大且室壁变薄[9]。沉默NLRP3治疗后,心功能均有所恢复。siNLRP3-NBs暴露于超声辐照下治疗效果明显提高[(US-vs.US+:LVFS(35.3±1.6)%vs.(47.9±2.0)%,P<0.05;LVESP(64.2±2.9)mm Hgvs.(78.9±3.5)mm Hg,P<0.05;LVEDP(3.86±0.81)mm Hgvs.(3.21±0.38)mm Hg,P<0.05]。

图2 siNLRP3-NBs治疗后DCM 大鼠心功能变化Fig.2 Cardiac function changes in DCM rats after treatment with siNLRP3-NBS
2.3 UTMD增强siNLRP3对DCM 大鼠心肌纤维化及细胞焦亡的治疗作用
血糖及体质量结果显示,siNLRP3治疗后各组间无统计学差异,推测可能为定点心脏爆破siNLRP3-NBs,未作用于其他器官发挥生物学作用[10]。图3A 为心脏HE染色及Masson 染色结果。HE 染色结果显示,DCM 组出现明显心肌结构损伤,治疗后结构恢复程度明显,US-与US+相比结构损伤程度相对较高。对Masson染色进行CVF分析数据显示,与HE染色结果一致,siNLRP3-NBs联合UTMD治疗后心肌纤维化程度明显下降[US-vs.US+:CVF值(21.2±3.6)%vs.(14.0±1.8)%,P<0.05]。Western blotting结果显示(图3B,图3C),UTMD 可促进NBs介导的NLRP3沉默,NLRP3在US+组表达最低,与NLRP3蛋白变化一致;与CON 组相比,焦亡标志物GSDMDN、IL-β及caspase-1表达升高,灰度值分析结果显示,siNLRP3联合UTMD治疗后标志蛋白表达明显下降,提示US+组抑制焦亡能力最为显著。图3D 为心脏超声造影图,可观察到大鼠心脏内充盈NBs,UTMD爆破后可大量释放药物。

图3 心肌病理及焦亡水平改变Fig.3 Myocardial pathology and pyroptosis changes
DCM 发病机制复杂,患者体内高血糖诱导产生的活性氧簇(reactive oxygen species,ROS)被认为是DCM 发生发展的主要原因[11]。ROS产生可诱导炎症小体(NLRP3)激活[12]。NLRP3 激活后可促进pro-caspase-1转化为活性caspase-1 p10/20四聚体。caspase-1激活后切割GSDMD 蛋白(GSDMD-N),其N 端转位插入质膜,形成内径10~20 nm 的孔隙,同时,活化的caspase-1还会激活IL-1β等炎症因子,活化的炎症因子通过GSDMD-N制造的孔洞释放到细胞外,形成细胞焦亡表型[13-14]。因此,使用siRNA 沉默NLRP3是治疗DCM 的一种潜在策略。但是siRNA体内稳定性差、转染效率低,限制了siRNA 类药物的临床应用[13]。
UTMD 介导超声响应复合纳米微泡在增强基因药物稳定性提高转染效率方面显示出巨大潜力[14]。mPEG-b-PLLys胶束复合纳米载体系统是一种优良的超声响应载体,mPEG-b-PLLys可在体内降解为赖氨酸,具有生物相容性好、毒性小、易被机体吸收代谢等优点。作为两亲性嵌段共聚物,mPEG-b-PLLys可通过自组装与基因药物形成胶束,胶束再通过异组装与气芯纳米脂质体复合形成超声响应复合纳米微泡。该微泡已被证实具有良好的超声响应能力,可增加基因药物载药量,改善其体内稳定性;与传统微泡相比,在致密的组织内具有更好的穿透力及转染能力[15-16],但其对心血管疾病的治疗效果有待研究。
本研究使用mPEG-b-PLLys复合纳米微泡作为载体介导siNLRP3治疗DCM,结果显示,UTMD可有效增强siNLRP3-NBs对DCM 的治疗作用,改善心肌纤维化及细胞焦亡。国家药品监督管理局已发布《基因治疗产品非临床研究与评价技术指导原则(试行)》,我们后续研究将会重点关注长期使用UTMD治疗的安全性及siNLRP3-NBs量效关系,为其临床转化提供参考数据。
猜你喜欢 共聚物焦亡脂质体 细胞焦亡在重要器官缺血再灌注损伤中的研究进展*重庆医学(2022年7期)2022-11-23细胞焦亡在妇科恶性肿瘤中的研究进展中国计划生育和妇产科(2022年6期)2022-11-15针刺对脑缺血再灌注损伤大鼠大脑皮质细胞焦亡的影响世界科学技术-中医药现代化(2022年3期)2022-08-22含长碳链季铵盐的丙烯酰胺类共聚物的合成及其水溶液特性东华大学学报(自然科学版)(2022年3期)2022-06-25PEG6000修饰的流感疫苗脂质体的制备和稳定性昆明医科大学学报(2022年3期)2022-04-19miRNA调控细胞焦亡及参与糖尿病肾病作用机制的研究进展医学综述(2022年7期)2022-04-19高三尖杉酯碱类脂质体的制备及其稳定性中国药学药品知识仓库(2021年18期)2021-02-28RAFT 聚合制备丙烯酸酯嵌段共聚物的研究商品与质量(2020年18期)2020-07-27脂质体研究进展及制备方法信息技术时代·上旬刊(2019年4期)2019-09-10水解度对AM—DB/BS14共聚物耐温抗盐性能的影响科技视界(2017年17期)2017-11-07 相关热词搜索:糖尿,超声,负载,






