热应激对不同泌乳阶段奶牛应激、抗氧化和肝功能相关指标的影响
时间:2023-02-20 15:45:05 来源:千叶帆 本文已影响人
姚志兰,程李杰,沈留红,曹随忠,王绍熙,傅宏庆
(1.江苏农牧科技职业学院,江苏 泰州 225300;
2.四川农业大学动物医学院/动物疫病与人类健康四川省重点实验室/奶牛疾病研究中心,成都 611130;
3.重庆市农业广播电视学校,重庆 401121)
夏季热应激期间,奶牛受高温高湿环境影响,生理生化状态易发生改变[1-2],探究热应激对奶牛血液生化指标的影响,可为改善热应激奶牛饲养管理和疾病预防提供理论数据支持。奶牛热应激反应,目前多使用温湿指数(temperature-humidity index,THI)评估其热应激状态,THI<71为热舒适区,72~79为轻度热应激区间,80~90为中度热应激区间,THI>90为重度热应激区间[3]。热应激导致奶牛机体新陈代谢活动增强,代谢稳态被打破,自由基的氧化和抗氧化失去平衡,引发氧化应激反应[4],体内应激金指标——热休克蛋白70(heat shock protein 70,HSP70)、皮质醇(cortisol,Cor)浓度改变,抗氧化酶系统超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)等活性与抗氧化非酶系统维生素C、E和类胡萝卜素等物质含量发生改变[5-6],过氧化产物丙二醛(malondialdehyde,MDA)、总抗氧化能力(total anti⁃oxidant capacity,T-AOC)等发生变化[7-8]。同时为应对因采食量下降和维持产奶量、机体体热平衡导致的能量负平衡状态,奶牛加强脂肪动员和蛋白质分解为机体供能[9],当机体代谢强度超过肝脏正常功能范围时,将引发机体损伤,使脂代谢相关指标游离脂肪酸(non-esterified fatty acid,NEFA)、急性时相反应蛋白结合珠蛋白(haptoglobin,HP)和肝损伤特异性指标谷氨酸脱氢酶(glutamate dehydroge⁃nase,GDH)等健康相关指标发生改变,影响动物正常代谢与免疫功能,使脂肪肝、酮病等代谢性疾病和乳房炎等潜在发病率上升[10-11]。目前关于热应激期对不同泌乳阶段奶牛血液生化指标的影响仍不清楚,而监测热应激期奶牛生化指标的改变有助于及时掌握机体新陈代谢活动、组织器官生理机能变化和奶牛健康状况,为改善日常管理、提高奶牛福利和养殖收益提供可靠理论支持。本试验旨在探究热应激期与非热应激期不同泌乳阶段奶牛血清应激指标、抗氧化指标和肝功能相关指标等的变化,了解热应激期奶牛血液生化指标变化趋势,为针对性改进夏季防暑降温策略,改善奶牛福利和提高养殖收益提供可行的理论依据。
1.1 试验时间和地点
本试验所有程序均严格按照科技部《关于善待实验动物的指导性意见》(第398号,2006年)执行,并遵照《四川农业大学实验动物福利》(2013—028号)照料、使用试验奶牛。试验地点为四川省资阳市某规模化奶牛场,属亚热带季风气候。牛场热应激期共有泌乳牛856头,非热应激期共有泌乳牛896头。热应激期试验时间为2018年7—8月,非热应激期试验时间为2018年11—12月。
1.2 试验动物与管理方案
按泌乳天数将全群泌乳牛分为新产(0~21 d)、泌乳前期(22~120 d)、泌乳中期(121~200 d)、泌乳后期(201~305 d)4个期,每次采集数据时在各期泌乳牛中随机选择体况相近、同一泌乳阶段、泌乳天数相近的健康经产奶牛(2~4胎次)10头,共计80头作为试验奶牛。试验奶牛热应激期和非热应激期管理方案和饲养方法按牧场日常运行方案进行管理,不进行其他人工干预。
1.3 试验方法
1.3.1 温湿指数的测定
在牛舍饲喂槽的前、中、后3个位置离地2.5 m安装电子温湿度计(博洋仪器,郑州),每日08:00、14:00、20:00测定温湿度数据,计算温湿指数(temperature-humidity index,THI)。取3个时间点THI平均值作为试验值,THI计算公式为:THI=(1.8×Td+32)-(0.55-0.0055×RH)×(1.8×Td-26)[12],其中Td为摄氏温度(℃),RH为相对湿度(%)。
1.3.2 直肠温度的测定
每天08:00、15:00、20:00使用兽用电子温度计(尚农科技,绵阳)测定各阶段泌乳牛直肠温度,连续监测20 d,分别取各泌乳阶段奶牛测定结果的平均值作为试验值。热应激和非热应激期采取相同测定方案。
1.3.3 血样采集与血清制备
随机选取热应激中期任一高温高湿天气和非热应激期任意一天,在16:00采集各试验奶牛尾根静脉血,6 000 r/min,离心5 min,分离血清,-20℃保存待检。
1.3.4 血清生化指标的检测
采用酶联免疫吸附试验(ELISA)测定HSP70、Cor、GDH和HPT;
采用ABTS快速法测定T-AOC;
采用WST-1法测定SOD;
采用硫代巴比妥酸(TBA)法测定MDA;
采用微板法测定NEFA。以上指标采用试剂盒并按照试剂盒说明书在Varioskan Flash全波长多功能酶标仪(Thermo,美国)上测定,试剂盒均购自南京建成生物工程研究所。
1.4 数据处理
本试验数据使用SPSS 25.0软件进行成对样本T检验,所有统计结果均以“平均值±标准差”(Mean±SD)的形式表示。
2.1 各泌乳阶段奶牛直肠温度变化
试验期间不同泌乳阶段奶牛直肠温度及舍内温湿指数如表1、表2所示。热应激期各泌乳阶段奶牛直肠温度较非热应激均具有极显著差异(P<0.01),分别升高0.9、0.7、0.6和0.5 ℃。热应激期泌乳中、后期奶牛及直肠温度无显著性差异(P>0.05),其余各时期间均具有显著差异(P<0.05),非热应激期各泌乳阶段奶牛直肠温度无显著性差异(P>0.05)。热应激期牛舍内温湿指数处于中度热应激区间。
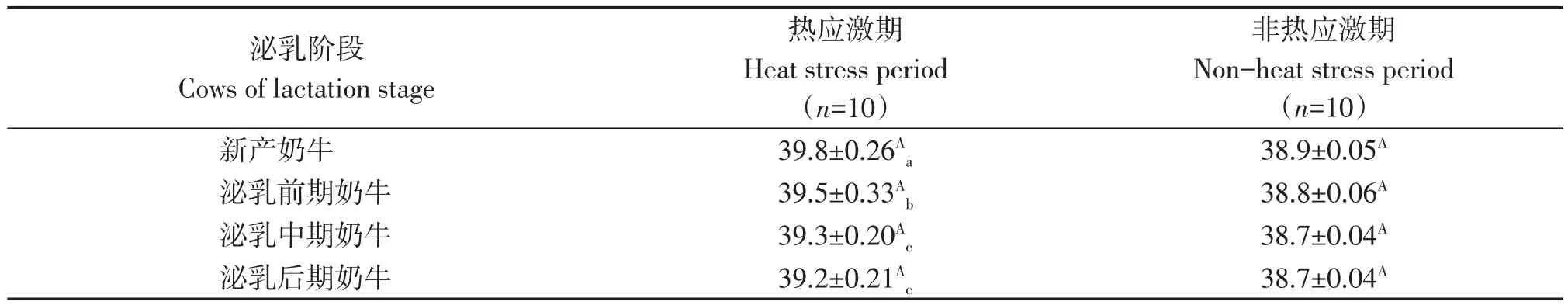
表1 各泌乳阶段奶牛直肠温度变化Table 1 Rectal temperature of cows at different lactation stages during test period

表2 试验期间牛舍温湿指数Table 2 Humidity-temperature index of cowshed during test period
2.2 热应激对不同泌乳阶段奶牛血清应激指标的影响
热应激期与非热应激期不同泌乳阶段奶牛血清应激指标如表3所示。与非热应激期比较,热应激期各泌乳阶段奶牛血清应激指标HSP70蛋白均出现极显著上升(P<0.01),以新产奶牛最高,且与泌乳后期奶牛间具有显著差异(P<0.05)。热应激期各泌乳阶段奶牛Cor均极显著上升(P<0.01),以泌乳中期奶牛最高,新产、泌乳前期奶牛与泌乳中、后期奶牛间具有显著性差异(P<0.05),非热应激期新产奶牛、泌乳前期、中期奶牛与泌乳后期奶牛间具有显著差异(P<0.05)。

表3 不同泌乳阶段奶牛血清应激相关指标的差异Table 3 The difference of serum stress indexs in cows at different lactation stages
2.3 热应激对不同泌乳阶段奶牛血清抗氧化指标的影响
热应激期和非热应激期不同泌乳阶段奶牛血清抗氧化指标测定结果如表4所示。与非热应激期比较,热应激期各泌乳阶段奶牛间血清SOD活性极显著升高(P<0.01),而热应激期各泌乳阶段奶牛间无显著性差异(P>0.05);
非热应激期新产奶牛与泌乳前期、中期、后期奶牛间具有显著性差异(P<0.05)。热应激期新产奶牛、泌乳前期奶牛血清T-AOC水平极显著降低(P<0.01),泌乳中期奶牛显著降低(P<0.05),泌乳后期奶牛无显著性差异(P>0.05),新产奶牛、泌乳前期、中期奶牛与泌乳后期奶牛间具有显著差异(P<0.05),非热应激期泌乳后期与新产奶牛、泌乳前期、中期奶牛有显著差异(P<0.05)。热应激期新产奶牛血清MDA浓度显著升高(P<0.05),泌乳前期、中期奶牛极显著升高(P<0.01),泌乳后期奶牛间无显著性差异(P>0.05),新产奶牛与泌乳前期、中期奶牛间具有显著性差异(P<0.05),与泌乳后期奶牛间无差异性,非热应激期各泌乳阶段奶牛间差异不显著(P>0.05)。

表4 不同泌乳阶段奶牛血清抗氧化相关指标的差异Table 4 The difference of serum antioxidant indexs of cows at different lactation stages
2.4 热应激对不同泌乳阶段奶牛肝功能相关指标的影响
热应激期和非热应激期不同泌乳阶段奶牛肝功能相关指标如表5所示。热应激期新产奶牛、泌乳前期奶牛血清NEFA浓度较非热应激期极显著上升(P<0.01),泌乳中期奶牛NEFA浓度显著上升(P<0.05),泌乳后期奶牛间无显著性差异(P>0.05),热应激期泌乳中期、后期奶牛间无显著性差异(P>0.05);
热应激期各期泌乳牛之间血清GDH浓度极显著升高(P<0.01),组内无显著性差异,非热应激期新产奶牛、泌乳前期奶牛与泌乳中期、后期奶牛间差异显著(P<0.05);
热应激期新产奶牛、泌乳前期和中期奶牛血清HP浓度极显著升高(P<0.01),泌乳后期奶牛无显著性差异(P>0.05),新产奶牛、泌乳前期、中期奶牛与泌乳后期奶牛间具有显著性差异(P<0.05),非热应激期无组内差异(P>0.05)。

表5 不同泌乳阶段奶牛肝功能相关指标的差异Table 5 The difference of liver function indexes of cows at different lactation stages
3.1 热应激对不同泌乳阶段奶牛血清应激指标的影响
HSP70是分子量约70 kD的热休克蛋白,正常情况下位于胞浆内,表达水平较低,而在高温或各种有害应激状态下,HSP70合成速度显著增加,一般数分钟内即可达到最高水平,提高生物体抗应激能力,从而保护机体或细胞的功能。本试验中热应激期各泌乳阶段奶牛HSP70均极显著高于非热应激期(P<0.01),与de Fátima Bretanha Rocha等[13]研究结果一致。另外,本试验中HSP70新产奶牛最高,表明新产奶牛受热应激侵害程度最为严重。泌乳前期、中期奶牛血清HSP70含量较泌乳后期奶牛高,表明泌乳前期、中期奶牛受热应激侵害程度高于泌乳后期奶牛。
Cor作为糖皮质激素之一,对体内糖、脂肪、蛋白质的代谢均有调节作用,可促进糖原异生及蛋白质和脂肪的分解,增强机体代谢能力,加速分解脂肪、蛋白质、糖类应对应激刺激,被视为机体应激金指标[14]。本试验中热应激期各泌乳阶段血清Cor浓度极显著上升(P<0.01),表明各期奶牛均受到热应激影响,机体代谢活动增强,与宋代军等[5]研究结果一致。泌乳前期、中期奶牛较泌乳后期奶牛血清Cor浓度上升幅度更大,表明泌乳前期、中期奶牛受热应激影响更大,其能量需求更高,代谢活动更强。
3.2 热应激对不同泌乳阶段奶牛血清抗氧化能力的影响
动物处于热应激状态时,机体内产生大量自由基,引发氧化应激,造成机体氧化损伤[15]。SOD活性可反映机体清除氧自由基的能力,本试验中,热应激期不同泌乳阶段奶牛SOD活性极显著上升(P<0.01),与王换换等[16]和王菲等[17]对热应激奶牛、小鼠肝脏SOD指标的研究结果相一致,其原因可能是机体在高温胁迫下出现代偿反应。两个试验时期中各时期新产奶牛血清SOD和T-AOC水平最低,这可能是导致热应激期新产奶牛产后疾病多发的重要原因之一。
T-AOC是反映机体抗氧化机能的综合性指标,MDA为机体过氧化反应的终产物,高强度的代谢与应激都会导致其含量增加,可间接反映机体脂质过氧化程度[18-19]。本试验中热应激期新产奶牛、泌乳前期、中期奶牛T-AOC较非热应激期出现不同程度降低,且两试验时期中各泌乳阶段奶牛和泌乳后期奶牛间均出现显著性差异(P<0.05),以新产奶牛TAOC最低,泌乳后期奶牛最高。新产奶牛、泌乳前期、中期奶牛MDA含量较非热应激期不同程度升高,表明以上泌乳阶段奶牛脂质过氧化程度加剧,机体总抗氧化能力下降,其中以泌乳前期、中期奶牛脂质过氧化程度最高,泌乳后期奶牛较低。I.Politis等[20]的研究表明氧化应激水平与奶牛乳房炎发病率呈正相关,本试验结果提示不同泌乳阶段奶牛血清抗氧化指标的变化可能是造成新产奶牛与泌乳前期、中期奶牛热应激期疾病多发的原因之一。
3.3 热应激对不同泌乳阶段奶牛肝功能相关指标的影响
热应激期奶牛采食量下降,机体处于能量负平衡状态,为满足能量需求脂肪动员提高,导致NEFA在肝脏中大量储存、转化,甘油三酯、酮体等代谢产物大量积聚,最终导致奶牛产生酮病、脂肪肝等代谢性疾病[21]。本试验中不同泌乳阶段奶牛热应激期血清NEFA浓度较非热应激期极显著提高(P<0.01),表明泌乳牛体内脂肪动员程度极显著提高,新产、泌乳前期奶牛血清NEFA浓度更高,较泌乳中期、后期奶牛呈现显著性差异(P<0.05),说明新产、泌乳前期奶牛能量需求更大,脂肪动员更多,由此导致的潜在机体损伤也更加严重。
GDH为细胞线粒体酶,血清GDH浓度可较特异地反映肝细胞损伤及损伤程度,可作为诊断肝损伤重要指标[21-22]。本试验中,各泌乳阶段奶牛热应激期血清GDH浓度较非热应激期极显著升高,血清GDH浓度以新产奶牛、泌乳前期、中期和后期奶牛为序依次降低,无组内差异性(P>0.05),提示各泌乳阶段奶牛均存在一定程度的肝损伤,以新产奶牛最为严重,泌乳前期、中期奶牛肝损伤程度高于泌乳后期奶牛,机体健康状态更低。非热应激期存在组内差异性(P<0.05),表明经过长时间代谢累计,泌乳时间越长,泌乳牛肝脏损伤程度越大。
奶牛在应激状态下,刺激机体产生炎性细胞因子和糖皮质激素,诱导肝脏合成急性期反应蛋白HPT[23],此外热应激期奶牛发病率上升,酮病、脂肪肝等疾病都会损伤肝细胞,使外周血清HPT含量上升[24],同时奶牛乳房炎的发生也会导致HPT浓度增加,其浓度与炎症程度呈正相关。本试验中,热应激期新产奶牛、泌乳前期和中期奶牛血清HPT浓度出现不同程度上升,泌乳后期奶牛无显著性变化,3个泌乳阶段奶牛与泌乳后期奶牛间呈显著性差异(P<0.05),而非热应激期间各泌乳阶段奶牛间无组内差异(P>0.05),表明受热应激影响,机体损伤以新产奶牛、泌乳前期和中期奶牛更为严重,酮病、脂肪肝和乳房炎等疾病的潜在发病率也可能相应提高。
综上,各泌乳阶段奶牛在热应激期间产生应激反应,机体代偿性增加抗氧化酶活力,但脂质过氧化程度仍出现加剧情况,总抗氧化能力下降,机体健康状态出现不同程度的下降。因此,热应激期间应针对不同泌乳阶段奶牛血清指标变化,改善日粮结构,添加高效抗氧化剂,同时给予全群泌乳牛更多防暑降温措施,对新产奶牛、泌乳前期和泌乳中期奶牛进行更多健康监控,预防并及时发现热应激期间疾病的发生。
猜你喜欢 泌乳奶牛显著性 母乳钠离子浓度变化与泌乳启动关系的研究进展护理与康复(2022年4期)2022-11-25乍暖还寒时奶牛注意防冻伤今日农业(2022年3期)2022-11-16一种结合多尺度特征融合与像素损失加权的显著性目标检测方法黑龙江大学自然科学学报(2022年1期)2022-03-29视频序列中视觉显著性图像区域自动提取仿真计算机仿真(2021年7期)2021-11-17夏季奶牛如何预防热应激今日农业(2021年10期)2021-07-28叙事护理在母婴分离住院产妇保持正常泌乳状态的效果昆明医科大学学报(2021年5期)2021-07-22基于显著性权重融合的图像拼接算法电子制作(2019年24期)2019-02-23奶牛吃草小天使·一年级语数英综合(2019年12期)2019-01-13欧盟法院判决明确欧盟商标通过使用获得显著性的地域认定标准中国知识产权(2018年12期)2018-12-29母猪泌乳的影响因素及提高泌乳量的措施现代畜牧科技(2018年5期)2018-05-14 相关热词搜索:应激,肝功能,奶牛,






