细丝蛋白C对前列腺癌细胞迁移和侵袭的影响
时间:2023-03-03 11:15:04 来源:千叶帆 本文已影响人
孙振业,宋 斌,王 磊,宋 多,高闫尧,杨 帆(空军军医大学第二附属医院泌尿外科,西安 710032;
通讯作者,E-mail:yangfan4220@163.com)
前列腺癌(prostatic cancer)是男性人群中一种常见的恶性肿瘤[1],发生前列腺癌远处转移患者的5年生存率较低[2]。因此,前列腺癌的早期诊断和治疗对患者预后有直接影响。前列腺癌的恶性进展与各种遗传和表观遗传改变有关[3]。因此,识别调节前列腺癌进展的新基因可能有助于开发有效的前列腺癌治疗基因靶点。细丝蛋白C(filamin C,FLNC)是一种细丝蛋白家族的成员,可促进癌细胞的迁移和侵袭[4]。一些研究表明,FLNC蛋白在肝细胞癌肝组织中高表达,可能是控制肝细胞癌侵袭和转移的调控基因[5]。目前,定量蛋白质组学研究显示FLNC在前列腺癌细胞中上调,而敲除FLNC可抑制细胞迁移[6]。然而,目前尚无文献报道FLNC表达水平与前列腺癌患者预后的关系,及其调控癌细胞迁移和侵袭的可能机制。因此,本研究旨在探讨FLNC在前列腺癌患者前列腺癌组织及配对癌旁组织中的表达及其与患者临床特征和生存时间的关系,并探索其对癌细胞迁移和侵袭的影响。
1.1 材料
1.1.1 细胞和试剂 人前列腺癌细胞系(PC-3)购自美国ATCC公司。裂解缓冲液购自德国Roche公司。双抗、胎牛血清、RPMI-1640培养基购自美国HyClone公司。Lipofectamine 3000试剂、TRIzol试剂购自美国Invitrogen公司。PrimeScriptTMRT试剂盒购自日本Takara公司。FastFire qPCR PreMix(SYBR Green)购自天根生化科技(北京)有限公司。3,3-二氨基联苯胺(DAB)、结晶紫、MTT、RIPA缓冲液购自美国Sigma-Aldrich公司。Transwell、Matrigel购自美国Corning公司。BCA试剂盒、ECL试剂盒购自碧云天生物技术研究所。SDS-PAGE购自北京索莱宝科技有限公司。PVDF膜购自美国Millipore公司。一抗及二抗均购自英国Abcam公司。
1.1.2 研究对象 原发性前列腺癌组织及配对癌旁组织取自空军军医大学第二附属医院2019年1月至2021年10月期间收治的30例前列腺癌患者,所有组织均液氮保存。患者均为首次诊断,术前均未进行相关治疗。本研究经空军军医大学第二附属医院医学伦理委员会批准通过(批号:No.2019-1-21-SW0016),所有参与患者均知晓并签署知情同意书。
1.2 方法
1.2.1 免疫组化染色检测癌组织及癌旁组织中FLNC的表达 将石蜡包埋的组织切成5 μm厚的切片。组织切片用二甲苯脱蜡、梯度浓度乙醇复水、蒸馏水冲洗。然后将切片用3% H2O2浸泡10 min,0.01 mol/L柠檬酸盐缓冲溶液中煮沸3 min,冷却至室温。用5%牛血清白蛋白室温封闭1 h后,将切片与FLNC一抗(1 ∶500)在4 ℃孵育过夜,然后与辣根过氧化物酶标记的兔抗山羊IgG二抗(1 ∶500)室温孵育1 h。用DAB显色3~5 min,并用苏木精复染。放大倍数为400倍的光学显微镜下观察FLNC的染色情况。由两名病理学家独立选择每张切片中的5个随机视野,根据阳性染色细胞的百分比和染色强度,采用半定量评分系统对染色结果进行评估。强度评分0~3分(0分=阴性;
1分:弱;
2分:中度;
3分:强)。染色强度1~4分(1分:0%~25%;
2分:26%~50%;
3分:51%~75%;
4分:76%~100%)。阳性染色细胞的百分比和染色强度相乘计算最终染色评分。将所有患者分为FLNC低表达组(0~3分)和FLNC高表达组(4~12分)[7]。
1.2.2 细胞培养及shRNA转染 人前列腺癌细胞系(PC-3)是一种广泛用于前列腺癌基础研究的细胞系,本研究在预实验中检测显示,FLNC mRNA在PC-3细胞中的水平比人正常前列腺上皮细胞系(RWPE-1)升高了6.23倍,因此选用PC-3细胞进行本研究。将PC-3细胞在RPMI-1640培养基(含有10%胎牛血清和1%双抗)中于37 ℃、5% CO2的培养箱中培养。抑制FLNC表达的小干扰RNA(siRNA-FLNC组)和阴性对照(siRNA-NC组)购自上海吉玛制药技术有限公司。将PC-3细胞分为对照组、siRNA-NC组和siRNA-FLNC组,使用Lipofectamine 3000试剂将siRNA-NC和siRNA-FLNC分别转染到siRNA-NC组和siRNA-FLNC组细胞中,未转染的细胞作为对照组。通过qRT-PCR和Western blot验证转染效率。
1.2.3 qRT-PCR检测PC-3细胞中的FLNC mRNA表达水平 细胞转染48 h后,使用TRIzol试剂提取细胞总RNA。使用PrimeScriptTMRT试剂盒将RNA(2 μg)样品逆转录为cDNA。使用FastFire qPCR PreMix(SYBR Green)在美国Applied Biosystems STEP One Plus实时荧光定量PCR系统上进行PCR。RT-PCR引物:FLNC正向:5′-AGTGGCGTCAAGGTCTCAGG-3′,反向:5′-GCGGTGTACTGCACTCGGTA-3′;
GAPDH正向:5′-GCTCTCTGCTCCTCCTGTTC-3′,反向:5′-ACGACCAAATCCGTTGACTC-3′。GAPDH为内参。PCR反应条件为95 ℃预变性30 s,95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸90 s,72 ℃延伸10 min。使用2-ΔΔCt法计算mRNA表达水平,结果表示为对照组的表达倍数。
1.2.4 MTT法检测PC-3细胞活力 细胞转染48 h后,将细胞以4×103个/孔的密度接种到96孔板中。培养48 h后,向孔中加入200 μl的0.5 mg/ml的MTT。37 ℃孵育4 h后,去掉细胞培养液,加入150 μl二甲基亚砜。使用BIO-TEK酶标仪检测570 nm处的吸光度(OD值)。所有实验一式六份,取平均值,结果表示为对照组的OD值倍数。
1.2.5 Transwell实验检测PC-3细胞侵袭和迁移能力 细胞转染48 h后,采用Transwell实验检测PC-3细胞侵袭和迁移能力。
侵袭实验中,将4×104个细胞(200 μl无血清培养基)添加到孔径为8 μm的Transwell的上室中,上室预先用5%的Matrigel基质胶涂覆。下室加入800 μl含10%胎牛血清的培养基。37 ℃孵育48 h后,用湿棉签轻轻刮擦未迁移的细胞。侵袭的细胞用4%多聚甲醛固定15 min,然后用结晶紫染色。倒置显微镜下随机选取5个视野,计数侵袭的细胞数。
迁移实验中,将4×104个细胞接种在未进行Matrigel基质胶涂覆的上室中,其余步骤与侵袭测定相同。
1.2.6 Western blot检测PC-3细胞中FLNC、Eotaxin-1、CCR3、p-ERK1/2、t-ERK1/2和MMP-3的蛋白表达水平 细胞转染48 h后,将细胞用冷PBS洗涤3次,在含有蛋白酶抑制剂的RIPA缓冲液(50 mmol/L Tris pH 8.0,150 mmol/L NaCl,0.1%SDS,1%NP-40,0.5%脱氧胆酸钠)中裂解10 min。细胞裂解物以12 000 r/min离心15 min,然后收集上清液作为总蛋白。用BCA试剂盒测定蛋白质浓度。用10%~12%的SDS-PAGE凝胶分离蛋白质,并转移到PVDF膜上,用5%的脱脂牛奶在室温下封闭1 h,与FLNC(1 ∶2 000稀释)、Eotaxin-1(1 ∶2 000稀释)、CCR3(1 ∶2 000稀释)、p-ERK1/2(1 ∶2 000稀释)、t-ERK1/2(1 ∶2 000稀释)、MMP-3(1 ∶2 000稀释)和GAPDH(1 ∶2 000稀释)一抗在4 ℃下孵育过夜,然后与辣根过氧化物酶标记的二抗(1 ∶2 000稀释)在室温下孵育1 h。通过ECL试剂盒进行显影。GAPDH作为内部对照。
1.3 统计学分析
本研究采用SPSS 22.0软件和GraphPad Prism v8.0软件进行统计分析。计数数据采用卡方检验,计量数据采用配对t检验或单因素方差分析及Tukey事后检验。采用Kaplan-Meier法进行生存分析。P<0.05为差异有统计学意义。
2.1 FLNC蛋白在前列腺癌组织中高表达
免疫组化染色显示,FLNC主要在细胞质中表达(见图1)。与癌旁组织相比,前列腺癌组织中FLNC的染色评分升高(1.43±0.86vs5.63±2.91,t=7.143,P<0.001,见图2)。

图1 免疫组化染色检测FLNC蛋白在前列腺癌组织和癌旁组织中的表达 (×400)Figure 1 Expression of FLNC protein in prostate cancer tissue and adjacent tissue by immunohistochemical staining (×400)

与癌旁组织比较,*P<0.05图2 FLNC蛋白在前列腺癌组织和癌旁组织中染色评分Figure 2 Staining score of FLNC protein in prostate cancer tissue and adjacent tissue
2.2 FLNC低表达和高表达患者临床资料和生存时间的比较
根据免疫组化染色评分将30例患者分为低表达组(n=9)和高表达组(n=21)。两组患者的年龄和Gleason评分差异无统计学意义(P>0.05)。两组患者的TNM分期和淋巴结转移情况差异有统计学意义(P<0.05,见表1)。
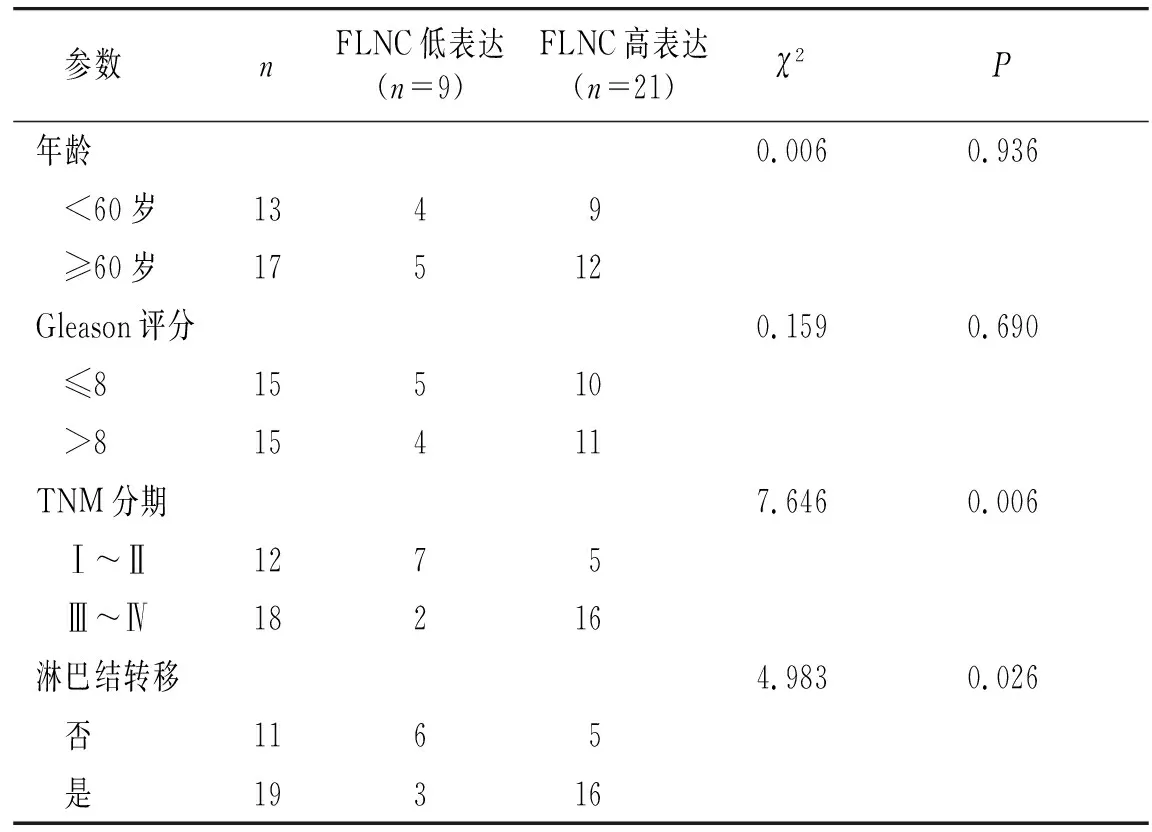
表1 FLNC低表达和高表达患者的临床参数Table 1 Clinical parameters of patients with low and high expression of FLNC
Kaplan-Meier生存分析显示,FLNC低表达和高表达患者的生存时间差异有统计学意义,FLNC低表达患者的生存时间更长(χ2=4.372,P=0.037,见图3)。
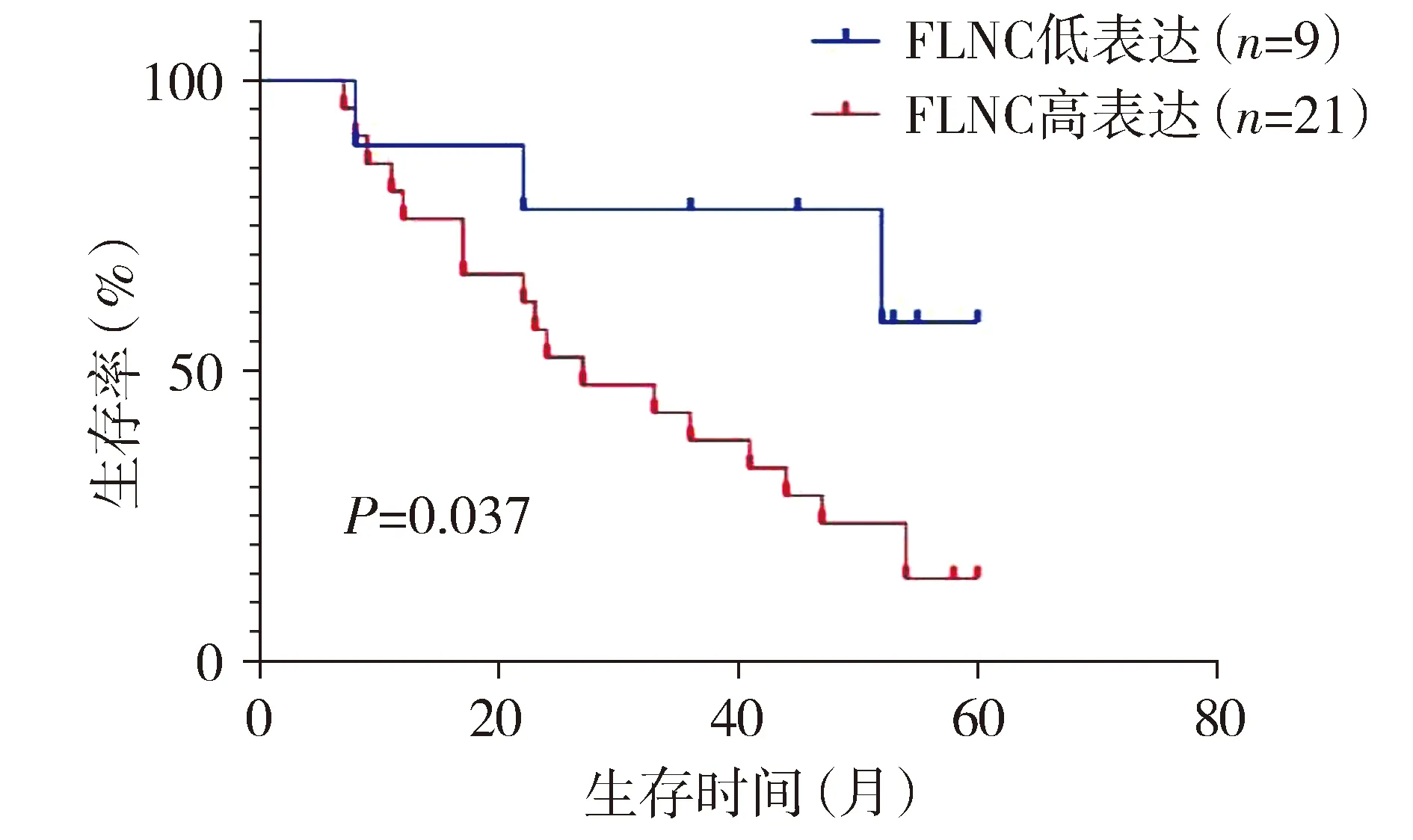
图3 FLNC低表达和高表达患者的Kaplan-Meier生存分析Figure 3 Kaplan-Meier survival analysis of patients with low and high expression of FLNC
2.3 沉默FLNC可抑制前列腺癌细胞的生长
与对照组或siRNA-NC组相比,siRNA-FLNC组PC-3细胞中FLNC的mRNA和蛋白水平均降低(P<0.05);
各组间比较,PC-3细胞中FLNC的mRNA和蛋白表达水平差异均有统计学意义(mRNA:F=948.739,P<0.001;
蛋白:F=558.216,P<0.001,见图4)。MTT实验结果显示,与对照组或siRNA-NC组相比,siRNA-FLNC组相对细胞活力降低了56.76%(P<0.05);
各组间比较,PC-3细胞的活力差异有统计学意义(F=304.147,P<0.001,见图5)。

与对照组比较,*P<0.05;
与siRNA-NC组比较,#P<0.05图4 转染siRNA-FLNC下调了PC-3细胞中FLNC的表达Figure 4 Transfection of siRNA-FLNC downregulates the expression of FLNC in PC-3 cells

与对照组比较,*P<0.05;
与siRNA-NC组比较,#P<0.05图5 沉默FLNC对PC-3细胞活力的影响Figure 5 Effects of silencing FLNC on PC-3 cell viability
2.4 沉默FLNC可抑制前列腺癌细胞的迁移和侵袭
Transwell实验结果显示,与对照组或siRNA-NC组相比,siRNA-FLNC组的细胞迁移和侵袭数量均降低(P<0.05);
各组间比较,PC-3细胞的迁移和侵袭能力差异有统计学意义(迁移:F=168.572,P<0.001;
侵袭:F=36.614,P<0.001,见图6)。

与对照组比较,*P<0.05;
与siRNA-NC组比较,#P<0.05图6 Transwell实验检测沉默FLNC对PC-3细胞迁移和侵袭的影响 (×400)Figure 6 Effects of silencing FLNC on PC-3 cell migration and invasion by Transwell (×400)
2.5 沉默FLNC对前列腺癌细胞中Eotaxin-1/CCR3轴的影响
Western blot结果显示,与对照组或siRNA-NC组相比,siRNA-FLNC组PC-3细胞中Eotaxin-1、CCR3、p-ERK1/2和MMP-3的蛋白相对表达量均降低(P<0.05)。各组间比较,PC-3细胞中Eotaxin-1、CCR3、p-ERK1/2和MMP-3的蛋白相对表达量差异有统计学意义(Eotaxin-1:F=780.288,P<0.001;
CCR3:F=426.040,P<0.001;
p-ERK1/2:F=1 031.749,P<0.001;
MMP-3:F=490.832,P<0.001),t-ERK1/2的蛋白相对表达量差异无统计学意义(F=1.327,P=0.295,见图7)。

与对照组比较,*P<0.05;
与siRNA-NC组比较,#P<0.05图7 Western blot检测沉默FLNC对PC-3细胞中Eotaxin-1/CCR3轴相关蛋白表达的影响Figure 7 Effects of silencing FLNC on the expression of Eotaxin-1/CCR3 axis-related proteins in PC-3 cells by Western blot
细丝蛋白(filamin,FLN)是一组肌动蛋白结合蛋白,参与调节细胞内的肌动蛋白细胞骨架,并且调节肿瘤细胞的恶性行为[8,9]。FLNC属于FLN家族,Qi等[5]通过iTRAQ方法鉴定了肝细胞癌患者肝组织中4 620个蛋白质,并对其中3 781个蛋白质进行了定量分析,发现FLNC在癌组织中过表达,且参与了癌细胞的迁移、侵袭、黏附等多种功能[5]。Tanabe等[4]研究表明,FLNC在食管鳞癌中高表达,且与淋巴侵袭、转移和预后有关。Kamil等[10]报道,FLNC表达增高与多形性胶质母细胞瘤(glioblastoma multiforme,GBM)患者预后不良相关。Adachi-Hayama等[11]也报道FLNC在胶质瘤组织中的表达水平随肿瘤分级的升高而升高。Ai等[6]通过定量蛋白质组学证实FLNC在高迁移潜能的前列腺癌细胞中高表达,下调FLNC可显著抑制前列腺癌细胞迁移。与这些研究一致,本研究观察到前列腺癌组织中FLNC的表达高于癌旁组织。此外,FLNC的高表达与TNM分期、淋巴结转移和生存期显著相关。
癌细胞的转移与其迁移和侵袭能力直接相关。Kamil等[10]研究显示,GBM细胞系中FLNC过表达与侵袭力增强呈正相关。Tanabe等[4]报道,FLNC基因敲除减少了食管鳞状细胞癌细胞迁移和侵袭,其机制是通过激活Rho GTP酶以增加细胞的转移能力而实现的。本研究推测FLNC可能参与了对前列腺癌细胞迁移和侵袭能力的调节。研究显示,沉默FLNC抑制了PC-3细胞的生长、迁移和侵袭。基质金属蛋白酶(matrix metalloproteinase,MMPs)家族是调控肿瘤侵袭和转移的重要蛋白家族,MMPs通过降解各种细胞外基质参与癌细胞的侵袭过程[12]。MMP-3的高表达提高了多种癌细胞的迁移和侵袭能力[13,14]。本研究检测了PC-3细胞中MMP-3的表达,研究显示,沉默FLNC下调了PC-3细胞中MMP-3的表达。此外,ERK通路是调控癌症恶性转化的重要途径[15],并且,MMP-3的活性受到ERK通路的调节[16-18]。本研究中,沉默FLNC也抑制了PC-3细胞中ERK1/2的激活,这些结果提示FLNC对前列腺癌细胞迁移和侵袭的调控作用可能是由ERK1/2-MMP-3通路介导的。
趋化因子和受体网络调节癌细胞的迁移和侵袭[19-22]。嗜酸性粒细胞趋化因子(Eotaxin)家族是一组归巢相关的CC趋化因子[23-25]。据报道,Eotaxin-1是一种候选前列腺癌生物标记物[26]。Eotaxin-1主要通过其受体CC趋化因子受体-3(CC chemokine receptor 3,CCR3)发挥作用,并且Eotaxin-1和CCR3在人肾细胞癌、胶质母细胞瘤等癌细胞中表达上调[27-29]。Eotaxin-1和CCR3的高表达促进了间变性大细胞淋巴瘤细胞的生长和存活[30]。另外,Eotaxin-1通过激活CCR3还可促进脉络膜血管内皮细胞的移行[31]。本研究显示,沉默FLNC降低了PC-3细胞中Eotaxin-1和CCR3的表达。据报道,CCR3在淋巴瘤细胞中可激活ERK通路[30],而Eotaxin-1通过激活ERK1/2上调人软骨细胞中MMP-3的表达[32]。Eotaxin-1通过CCR3-ERK通路上调MMP-3的表达,并促进前列腺癌细胞的侵袭[33]。由以上研究背景推测,FLNC的高表达可能通过激活Eotaxin-1-CCR3-ERK1/2-MMP-3通路进而促进前列腺癌细胞的迁移和侵袭。
综上所述,本研究表明FLNC在前列腺癌组织中高表达并且与患者预后相关。沉默FLNC可能通过抑制Eotaxin-1-CCR3-ERK1/2-MMP-3通路降低前列腺癌细胞的迁移和侵袭能力。
猜你喜欢 癌细胞前列腺癌染色 节水染色和非水介质染色技术的研究进展纺织科技进展(2021年4期)2021-07-22癌细胞最怕LOVE奥秘(创新大赛)(2019年9期)2019-10-09MTA1和XIAP的表达与前列腺癌转移及预后的关系天津医科大学学报(2019年3期)2019-08-13假如吃下癌细胞小哥白尼(趣味科学)(2019年1期)2019-04-12前列腺癌,这些蛛丝马迹要重视中国生殖健康(2019年7期)2019-01-06美丽疗法打败癌细胞特别健康(2018年3期)2018-07-04癌细胞最怕Love奥秘(2017年5期)2017-07-05两类图的b—染色数和研究中国市场(2017年5期)2017-03-15前列腺癌治疗与继发性糖代谢紊乱的相关性中国男科学杂志(2016年5期)2016-12-01微小RNA-424-3p和5p对人前列腺癌细胞LNCaP增殖和迁移影响的比较中国男科学杂志(2016年5期)2016-12-01 相关热词搜索:细丝,癌细胞,侵袭,






