JAK1/STAT1信号通路在白藜芦醇减轻大鼠局灶性脑缺血再灌注损伤中的作用机制
时间:2023-03-10 19:15:05 来源:千叶帆 本文已影响人
宋光捷 方毅 陈黎 冯建青
(1湖北文理学院附属医院 襄阳市中心医院神经内科,湖北 襄阳 441000;
2中国人民解放军联勤保障部队第九九一医院骨科;
3中国人民解放军96608部队医院内一科)
缺血性脑卒中是全世界范围内导致死亡和残疾的主要原因之一,尽管大量的神经保护剂被不断研究和开发,但仍未取得满意的效果〔1〕。缺血性脑卒中在溶栓治疗过程中,极有可能出现脑缺血再灌注损伤,进而造成神经细胞损伤或促进神经元凋亡〔2〕。因此,深入了解缺血再灌注所导致的氧化应激损伤机制,为缺血性脑卒中提供新的治疗方法,具有十分重要的意义。Janus激酶(JAK)1是Janus激酶家族中的成员之一,存在于细胞膜表面,信号转导与转录激活子(STAT)1是STAT家族中的成员之一,存在于细胞质中,JAK1/STAT1信号通路在细胞生长、凋亡中起着关键的调控作用〔3〕。机体一旦出现应激反应,细胞膜表面的JAK1被异常激活,随后STAT1被JAK1激酶的细胞质酪氨酸激酶磷酸化,进而启动细胞凋亡等一系列信号通路〔4〕。研究表明〔5〕,抑制JAK1/STAT1信号通路可抑制小胶质细胞的激活,减轻缺血性脑损伤。白藜芦醇(Res)是一种多酚类化合物,存在于葡萄、桑葚、花生和葡萄酒中,被认为是一种有效的抗氧化、抗感染和抗凋亡药物〔6〕。研究表明〔7,8〕,Res对脑缺血再灌注损伤有一定的保护作用,但其详细作用机制有待进一步阐明。本研究探讨Res基于JAK1/STAT1信号通路减轻大鼠局灶性脑缺血再灌注损伤的作用机制。
1.1药品、试剂和仪器 Res(纯度>98%,北京索莱宝科技有限公司);
10%水合氯醛(成都市科龙化工试剂厂);
2%的2,3,5-氯化三苯基四氮唑(TTC)溶液(上海泽叶生物科技有限公司);
4%多聚甲醛(中国医药集团上海化学试剂公司);
免疫组化试剂盒(福州迈新生物技术开发有限公司);
RIPA裂解液、蛋白酶抑制剂(北京博奥森生物技术有限公司);
二喹啉甲酸(BCA)蛋白质浓度测定试剂盒、电化学发光(ECL)检测试剂盒(碧云天生物技术研究所);
鼠抗JAK1单克隆抗体、鼠抗STAT1单克隆抗体(英国Abcam公司;
辣根过氧化酶标记羊抗鼠IgG(北京中杉金桥生物有限公司)。
1.2实验动物 健康、清洁级SD雄性大鼠40只,8~10周龄,体重260~300 g,由南京君科生物工程有限公司提供,合格证号:SCXK(苏)2019-0002。所有大鼠喂养于标准环境中,控制温度为22~24℃,并使其自由摄取食物和水。动物研究均严格按照国家卫生研究所和医院动物伦理委员会所批准的实验动物护理和使用指南执行。
1.3模型建立和分组 适应性喂养所有大鼠1 w,并将大鼠随机分为假手术(Sham)组、脑缺血再灌注(I/R)组、Res低剂量组(10 mg/kg)、Res中剂量组(30 mg/kg)和Res高剂量组(60 mg/kg)各8只。采用文献介绍的大脑中动脉栓塞(MCAO)法以建立大鼠局灶性脑缺血再灌注模型,步骤如下,首先采用1 ml/100 g的10%水合氯醛溶液对大鼠进行腹腔注射麻醉,取仰卧位固定于手术台上,从颈正中行一切口,使得右侧颈总动脉暴露,并游离颈内动脉及颈外动脉,于颈外动脉距离颈总动脉交叉位置10 mm处结扎、离断,使用动脉夹夹闭颈总动脉和颈内动脉,并于颈外动脉距离颈总动脉交叉位置5 mm处作出一个小切口,将线栓(直径0.24 mm)经切口插入颈内动脉,结扎颈外动脉,将颈内动脉的动脉夹松开,继续将线栓插入到达右侧大脑中动脉,当线栓顶端距离颈总动脉分叉位置18~20 mm且感觉到有阻力时停止,并松开颈总动脉动脉夹,等到大鼠苏醒之后进行Longa神经功能缺失评分,≥2分则判断为栓塞成功,2 h后将线栓退到颈外动脉残端位置以实现再灌注,假手术组不插入线栓,并注射生理盐水,Res低、中、高剂量组于再灌注前通过大鼠尾部进行静脉注射10、30、60 mg/kg剂量的Res。
1.4方法
1.4.1各组神经功能缺失评分 再灌注24 h之后,参照Zea Longa评分标准对其神经功能缺损进行评分,采用4级评分法,0分:无神经功能缺失;
1分:轻度缺失,提尾时右前肢无法完全伸展;
2分:中度缺失,向右侧转圈;
3分:中至重度缺失,向右侧倾倒;
4分:重度缺失,意识丧失,甚至出现死亡。
1.4.2各组脑梗死体积和脑水肿率测定 再灌注24 h之后,取10%水合氯醛麻醉各组大鼠,断头取脑组织,均匀切成2 mm厚度冠状切片,并浸入2% TTC溶液中,并置于37℃恒温水浴锅中孵育30 min,再浸入4%多聚甲醛中固定24 h,取出脑切片平铺于培养皿中,并拍照,利用ImageJ软件测定脑梗死体积。使用电子天平测定大鼠左、右两侧大脑湿重,置入100℃烤箱24 h,再测定干重,脑水肿率=(脑组织湿重-脑组织干重)×100%。
1.4.3免疫组化染色检测凋亡相关蛋白表达 取各组脑组织进行石蜡包埋切片,常规脱蜡水化,再置于苏木素中染色5 min,清水冲洗,再水化15 s,清水冲洗,再放入75%酒精、85%酒精各2 min,再置于0.5%伊红中染色1 min,再次放入95%酒精Ⅰ、Ⅱ和100%酒精Ⅰ、Ⅱ中各5 min及二甲苯Ⅰ、Ⅱ中各5 min,最后,采用中性树胶封片,并在显微镜下观察脑组织形态变化。
1.4.4原位细胞凋亡检测法(TUNEL)检测缺血再灌注区脑神经元凋亡水平 取各组缺血再灌注区脑组织切片,常规脱蜡,滴加20 μg/ml不含DNA酶的蛋白酶K 50 μl,置于37℃烤箱孵育30 min,磷酸盐缓冲液(PBS)漂洗3次,5 min/次,再加入TUNEL检测液50 μl,37℃烤箱孵育1 h,PBS漂洗3次,5 min/次,最后使用抗荧光淬灭封片液在显微镜下进行观察。
1.4.5RT-聚合酶链反应(PCR)检测mRNA表达 取各组缺血再灌注区脑组织,采用RNA提取试剂盒提取总RNA,并采用反转录试剂盒将RNA样品反转录成cDNA,引物序列如下:GAPDH正向:5′-CCATGGAGAAGGCTGGGG-3′, 反向:5′-CAAAGTTGTCATGGATGACC-3′;
B细胞淋巴瘤(Bcl)-2正向:5′-AGGATTGTGGCCTTCTTTGA-3′,反向:5′-CAGATGCCGGTTCAGGTACT-3′;
Bcl-2相关X蛋白(Bax)正向:5′-GCTGGACACTGGACTTCCTC-3′, 反向:5′-ACTCCAGCCACAAAGATGGT-3′;
含半胱氨酸蛋白水解酶(caspase)-3正向:5′-TGCCAGAAGATACCAGTGGA-3′, 反向:5-TGACTGGATGAACCATGAC-C-3。引物由南京金斯瑞公司进行合成。最后采用SYBR试剂盒进行RT-PCR检测。
1.4.6Western印迹检测蛋白表达 取各组缺血再灌注区脑组织100 mg提取蛋白,并进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将分离胶转移至与目的蛋白区域大小对应的聚偏氟乙烯(PVDF)膜上,放入电泳槽进行转膜,加入一抗Bcl-2(1∶500)、Bax(1∶500)、caspase-3(1∶500)、JAK1(1∶500)、STAT1(1∶500)、p-JAK1(1∶500)、p-STAT1(1∶500)孵育4℃过夜,TBST缓冲液清洗3次,各5 min,加入辣根过氧化酶标记的二抗IgG(1∶1 000)室温孵育1 h,TBST缓冲液清洗3次,各5 min,最后滴加1∶1混匀的A液和B液,以GAPDH作为内参,将膜放入凝胶成像系统中,拍照,并采用ImageJ软件分析。
1.5统计学分析 采用SPSS20.0软件进行单因素方差分析。
2.1Res对I/R大鼠神经功能的影响 I/R组神经功能缺失评分显著高于Sham组(P<0.01),提示大脑中动脉栓塞后局部脑组织缺血,导致了明显的神经功能缺失;
Res低剂量组神经功能缺失评分与I/R组相比无明显变化(P>0.05),Res中、高剂量组神经功能缺失评分显著低于I/R组(P<0.01),其中Res中剂量组改善效果最佳。见表1。
2.2Res对I/R大鼠脑梗死体积和脑水肿率的影响 I/R组脑梗死体积、脑水肿率显著大于Sham组(P<0.01),Res低剂量组脑梗死体积、脑水肿率与I/R组相比无明显变化(P>0.05),Res中、高剂量组脑梗死体积、脑水肿率显著小于I/R组(P<0.05),表明30、60 mg/kg剂量的Res处理可显著降低I/R大鼠脑梗死体积、脑水肿率。见表1、图1。
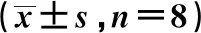
表1 各组神经功能缺失评分、脑梗死体积百分比、脑水肿率、神经元凋亡及脑组织Bcl-2、Bax、Caspase-3 mRNA表达比较
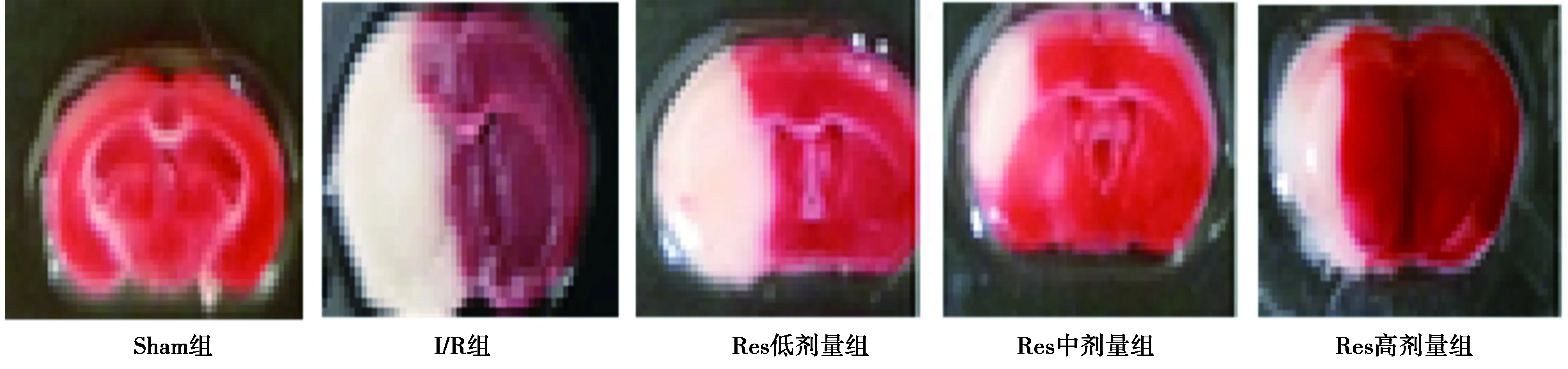
红色表示正常脑组织,白色表示脑梗死组织
2.3Res对I/R大鼠病理改变的影响 Sham组脑神经元细胞排列规则、紧密,形态正常,无间质水肿,核仁清楚可见;
I/R组脑缺血侧结构疏松,细胞轮廓模糊,间质明显水肿,细胞核固缩,细胞质嗜酸性增加,可见空泡形成;
Res低剂量、中、高剂量组病理损伤均有不同程度上的减轻,与I/R组相比,神经元结构相对完整,正常神经元细胞明显增多,Res中剂量组神经保护作用最明显。见图2。

图2 HE染色检测各组病理改变(×400)
2.4Res对I/R神经元凋亡的影响 I/R组阳性神经元数量显著多于Sham组(P<0.001),Res低剂量组阳性神经元数量与I/R组相比无明显变化(P>0.05),Res中、高剂量组阳性神经元数量显著少于I/R组(P<0.001),表明30、60 mg/kg剂量的Res处理可显著抑制I/R大鼠梗死区脑神经元凋亡。见表1。
2.5Res对I/R凋亡相关蛋白表达水平的影响 I/R组缺血再灌注区脑组织Bcl-2 mRNA和蛋白表达水平显著低于Sham组,Bax、caspase-3 mRNA和蛋白表达水平显著高于Sham组(P<0.05);
Res低剂量与I/R组相比无明显变化(P>0.05),Res中、高剂量组Bcl-2 mRNA和蛋白表达水平显著高于I/R组,Bax、caspase-3 mRNA和蛋白表达水平显著低于I/R组(P<0.05)。见表1、表2、图3。
2.6Res对I/R JAK1/STAT1信号通路的影响 I/R组缺血再灌注区脑组织p-JAK1、p-STAT1蛋白表达水平显著高于Sham组(P<0.01);
Res低剂量与I/R组相比无明显变化(P>0.05),Res中、高剂量组p-JAK1、p-STAT1蛋白表达水平显著低于I/R组(P<0.01),各组JAK1、STAT1蛋白表达水平相比无明显变化(P>0.05)。见表2、图4。
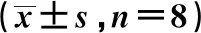
表2 各组脑组织Bcl-2、Bax、caspase-3、JAK1、p-JAK1、STAT1、p-STAT1蛋白表达比较

1~5:Sham组,I/R组,Res低剂量组,Res中剂量组,Res高剂量组;
图4同

图4 Res对I/R大鼠JAK1/STAT1信号通路的影响
缺血性脑卒中后脑损伤是由一些列复杂的病理生理事件所导致的,包括兴奋性毒性、氧化应激、炎症和细胞凋亡〔9〕。然而,有关缺血性脑卒中后脑损伤并无最佳治疗措施,原因与缺血性脑卒中后发生的细胞和分子变化并不完全清楚有关,这些变化也是导致神经元凋亡的原因之一。因此,对脑缺血再灌注损伤的分子机制进行深入研究,以制定出增加有效的治疗方案,对改善缺血性脑卒中患者预后具有十分重要的意义。
Res广泛存在于70多种植物中,具有很强的抗氧化活性,药理学研究显示,其可对炎症反应、氧化应激及心血管疾病等发挥作用〔10〕。报道发现,Res对心脏损伤/心肌梗死、出血性脑、肺、皮肤损伤等有一定的保护作用,而这些作用是通过抑制炎症和氧化应激,升高一氧化氮水平,介导离子通道激活以及促进自噬来实现的〔11〕。Fang等〔12〕研究表明,Res可降低脑缺血再灌注损伤模型大鼠脑梗死面积、脑水肿量,减少神经元凋亡,降低髓过氧化物酶和肿瘤坏死因子-α水平,提示Res对大鼠脑缺血再灌注损伤有保护作用,其机制可能与减轻脑缺血再灌注所致的炎症和细胞凋亡有关。本研究结果说明,模型建立成功,符合临床观察结果。本研究结果提示,中、高剂量Res能够减轻大鼠脑缺血再灌注损伤,改善神经功能,发挥脑组织保护作用。张跃奇等〔13〕报道亦表明,Res预处理干预可有效改善大鼠脑缺血再灌注损伤后神经功能。
JAK/STAT信号通路是一种多效性级联反应通路,能够将信号从质膜传至细胞核内〔14〕。JAK/STAT家族包含多个成员,其中JAK1/STAT1信号通路在缺血再灌注损伤中发挥着重要的作用〔15〕。有实验〔16〕表明,JAK1/STAT1信号通路可影响心肌缺血再灌注小鼠caspase-3表达,减轻心肌细胞凋亡,保护心肌组织〔16〕。另外,JAK1/STAT1信号通路被抑制以后,氧化应激反应明显受到抑制,炎症反应也明显减轻,脑组织凋亡亦减少,提示JAK1/STAT1信号通路能够减少神经元细胞凋亡,发挥脑保护作用〔17〕。本研究结果表明,Res处理可抑制p-JAK1、p-STAT1磷酸化,上调抗凋亡蛋白Bcl-2表达,抑制促凋亡蛋白Bax表达,同时抑制caspase-3表达,进而减少神经元细胞凋亡,以减轻脑缺血再灌注损伤,最终发挥脑组织保护作用。即Res可能是通过影响凋亡相关蛋白Bcl-2、Bax、caspase-3表达,来抑制神经元凋亡,进而减轻脑缺血再灌注损伤。既往研究〔18〕表明,Res可上调海马Bcl-2表达,进而减轻脑缺血神经损伤。Park等〔19〕通过建立大鼠脑缺血再灌注损伤模型发现,Res可激活蛋白激酶B(Akt)/糖原合成酶激酶(GSK)-3β信号通路,增加Akt、GSK-3β磷酸化水平,下调caspase-3表达,抑制细胞凋亡,发挥神经保护作用。Lei等〔20〕研究指出,采用Res处理MCAO法建立的大鼠发现,其神经功能缺损评分显著降低,脑水肿明显减少,炎症反应明显减轻,而使用磷脂酰肌醇-3激酶(PI3K)抑制剂LY294002抑制PI3K/Akt信号通路后,以上作用均被阻断,提示Res主要通过PI3K/Akt信号通路减轻局灶性脑缺血再灌注损伤。本研究初步阐明了Res处理可减轻大鼠局灶性脑缺血再灌注损伤的机制,但Res调节大鼠局灶性脑缺血再灌注损伤的详细分子机制有待深入研究。
综上,Res处理可减轻大鼠局灶性脑缺血再灌注损伤,其机制可能是通过抑制JAK1/STAT1信号通路,降低其磷酸化水平,进而影响凋亡相关蛋白Bcl-2、Bax、caspase-3表达,提示Res对缺血性脑卒中有一定的治疗价值。
猜你喜欢 脑缺血脑组织神经元 胆绿素改善大鼠脑缺血再灌注损伤的作用机制昆明医科大学学报(2020年11期)2020-12-28跃动的神经元——波兰Brain Embassy联合办公现代装饰(2018年5期)2018-05-26大黄总蒽醌提取物对脑缺血再灌注损伤的保护作用及其机制中成药(2018年4期)2018-04-26小脑组织压片快速制作在组织学实验教学中的应用中国组织化学与细胞化学杂志(2017年1期)2017-06-15芒果苷对自发性高血压大鼠脑组织炎症损伤的保护作用中成药(2017年6期)2017-06-13原花青素对脑缺血再灌注损伤后肠道功能的保护作用中国康复理论与实践(2015年10期)2015-12-24细胞外组蛋白与脑缺血再灌注损伤关系的初探中国体外循环杂志(2015年3期)2015-12-08ERK1/2介导姜黄素抑制STS诱导神经元毒性损伤的作用中国生化药物杂志(2015年4期)2015-07-07山楂叶总黄酮对2型糖尿病大鼠脑组织的保护作用医学研究杂志(2015年12期)2015-06-10毫米波导引头预定回路改进单神经元控制弹箭与制导学报(2015年1期)2015-03-11 相关热词搜索:灌注,通路,损伤,






