丹皮酚通过TLR4/MAPK/NF⁃κB,通路对LPS,诱导的巨噬细胞RAW264.7,损伤的保护作用
时间:2023-03-23 11:25:04 来源:千叶帆 本文已影响人
刘玉龙,孙 敏,刘 科,颜贵明
(安徽中医药大学,安徽 合肥 230012)
在先天免疫反应期间,炎症被激活以保护宿主组织和细胞免受病原体的损害,然而炎症介质持续刺激下的过度炎症反应已被证明会促进组织损伤和慢性炎症,此外持续的氧化应激可以激活多种转录因子,这也可能导致慢性炎症[1,2]。巨噬细胞是炎症反应的重要组成部分,并已被各种刺激物激活,如诱导炎症介质的脂多糖(LPS),多项研究发现,LPS 通过激活toll 样受体4(TLR4)激活巨噬细胞中的丝裂原活化蛋白激酶(MAPK)、核因子(NF)‑κB通路,引起机体氧化应激和炎症损伤[3,4]。丹皮酚(paeonol)来自于芍药科植物牡丹的干燥根及根茎中的有效成分之一。多项研究表明,丹皮酚具有抗氧化、抗炎、解热、镇痛、降脂、抗酒精性肝损伤等作用[5,6]。本课题组前期研究表明,酒精可破坏小鼠肠屏障,致使肠道中炎症介质经门静脉进入引起肝脏损伤,丹皮酚干预组肝炎症损伤减轻,肠屏障有所改善[7,8]。但丹皮酚改善炎性介质LPS 致肝损伤机制目前尚不清楚,因此本研究使用LPS 诱导巨噬细胞RAW264.7 损伤,探究丹皮酚对TLR4/MAPK/NF‑κB 通路的影响,并探讨其作用机制。
1.1 材料
巨噬细胞RAW264.7(上海生命科学研究院细胞生物学研究所),DMEM 培养基购自武汉塞维尔生物科技有限公司,货号(G4510);
丹皮酚(>99%)购自宣城市百草植物工贸有限公司,货号(T1903202);
TAK242(TLR4 抑制剂)购自美国MedChemexpress 生 物 科 技 公 司 ,货 号(HY‑100523);
CCK8 试剂盒、脂多糖(LPS)购自合肥 Biosharp 生 物 公 司,货 号 分 别(BS350B)(BS904);
胎牛血清购自天津康源生物技术有限公司,货号(KY‑01000S);
GSH、MDA 生化试剂盒购自南京建成生物工程研究所,货号分别(A006‑1‑1)(A003‑1‑1);
线粒体膜电位检测试剂盒(JC‑1)购自北京索莱宝公司,货号(M8650);
p38MAPK 抗体购自武汉三鹰生物技术有限公司,货号(14064‑1‑AP);
TLR4 抗体购自美国Affinity 公司,货 号(AF7017);
NF‑κB、p‑NF‑κB、p‑p38、JNK、p‑JNK 抗体购自成都正能生物技术有限责任公司,货 号 分 别(380172)(310052)(310091)(201001)(340810);
电泳仪购自北京六一仪器厂;
K3 型酶标仪购自美国赛默飞世尔科技公司;
OLYMPUS‑BX81 倒置显微镜购自日本奥林巴斯公司。
1.2 实验方法
1.2.1 巨噬细胞RAW264.7 培养 将RAW264.7细胞置于含有10%胎牛血清、1%青霉素‑链霉素的DMEM 培 养 基 中,放 于37℃、5%CO2培 养 箱 中培养。
1.2.2 CCK8 法检测不同浓度LPS 处理后的细胞活性 将巨噬细胞RAW264.7 种在96 孔细胞培养板中,每孔100 μL,细胞种板浓度3×105/ mL,24 h 后分别用0、0.25、0.5、1、2、4 μg/mL LPS,每组3 个平行孔,置于培养箱中24 h 后,每孔加入10 μL CCK8溶液,继续培养2 h 后使用酶标仪在450 nm 波长处检测每孔吸光度。
1.2.3 Western blotting 筛 选 丹 皮 酚 及TAK242 干预浓度 将巨噬细胞RAW264.7 3×105/ mL 接种于6 孔板中,每孔2 mL,培养24 h 后弃掉培养基,将细胞分成8 组,空白组加入2 mL 培养基、LPS(1 μg/mL)组加入2 mL LPS 浓度为1 μg/mL 培养基、丹皮酚各组加入2 mL LPS 浓度为1 μg/mL 及丹皮酚浓 度 分 别 为480、240、120 μmol/mL 培 养 基,TAK242 各组加入LPS 浓度为1 μg/mL 及TAK242浓度分别为20、10、5 μmol/mL 培养基,置于37℃细胞培养箱培养24 h,弃去培养基,加入PBS 缓冲液清洗2 遍。加入1 mL PBS 溶液,使用细胞刮刀刮下细胞,12 000 r/min 离心5 min,弃去PBS,加入含1% PMSF 及2% 磷酸酶抑制剂的裂解液中,提取组织蛋白。煮沸10 min 变性,冷却后电泳。一抗稀释比例TLR4、NF‑κB、p‑NF‑κB 均1∶1 000,二抗稀释比例(1∶5 000)。蛋白条带显色曝光后,使用Image‑J 软件进行灰度值分析。
1.2.4 细胞形态观察 将巨噬细胞RAW264.7 3×105/ mL 接种于6 孔板中,每孔2 mL,培养24 h 后弃掉培养基,将细胞分成4 组,空白组加入2 mL 培养基、LPS(1 μg/mL)组加入2 mL LPS 浓度为1 μg/mL 培养基、丹皮酚(240 μmol/mL)组加入2 mL LPS 浓度为1 μg/mL 及丹皮酚浓度为240 μmol/mL 培养基和TAK242(10 μmol/mL)组加入2 mL LPS 浓 度 为1 μg/mL 及TAK242 浓 度 为10 μmol/mL 培养基,置于37℃细胞培养箱培养24 h 后,使用倒置显微镜进行拍照(×200)。
1.2.5 细胞培养液中GSH、MDA 含量检测 造模方法同1.2.4,培养24 h 后,取出培养基3 000 r/min离心10 min,取上清,按照GSH、MDA 试剂盒说明书进行测定。
1.2.6 细胞线粒体膜电位检测 造模方法同1.2.4,培养24 h 后,弃去培养基,加入PBS 缓冲液清洗两遍。加入1 mL 细胞培养液和1 mL JC‑1 染色工作液,置于37℃细胞培养箱孵育20 min。之后吸出上清,加入JC‑1 染色缓冲液洗涤2 次,再加入2 mL 细胞培养基在倒置荧光显微镜下拍照(×200)。
1.2.7 免疫荧光法检测F4/80 及p‑NF‑κB 蛋白表达分布 造模方法同1.2.4,培养24 h 后,弃去培养基,加入PBS 缓冲液清洗两遍。4%多聚甲醛固定20 min,PBS 清洗3 次,0.1%Triton X‑100 透 化5 min,PBS 清洗3 次,10%BSA 封闭30 min,滴加F4/80(1∶50)及p‑NF‑κB(1∶100)抗体于4℃冰箱孵育过夜,清洗3 次,滴加山羊抗兔IgG‑FITC(1∶100),孵育1 h,PBS 洗3 次,滴加DAPI 工作液,染色5 min,PBS洗3 次,荧光扛衰减封片剂封片,倒置荧光显微镜拍照(×200)。
1.2.8 Western blotting 检测TLR4/MAPK/NF‑κB通路蛋白表达 造模方法同1.2.4,蛋白提取方法同1.2.3。一抗稀释比例p38、p‑p38、JNK、p‑JNK、IκB、p‑IκB 抗体均1∶1 000,二抗稀释比例(1∶5 000)。蛋白条带显色曝光后,使用Image‑J 软件进行灰度值分析。
1.3 统计学处理
2.1 LPS 致巨噬细胞RAW264.7 活性最佳浓度筛选
当LPS 浓度在1 μg/mL 时细胞活性OD 值为0.4972±0.061,且与空白组比较差异具有统计学意义(P<0.01、P<0.001),更 接 近 半 数 抑 制 率。见表1。
表1 LPS 致巨噬细胞RAW264.7 活性最佳浓度筛选(n=3)Tab1 Selection of the best concentration of LPS⁃induced macrophage RAW264.7 activity(n=3)

表1 LPS 致巨噬细胞RAW264.7 活性最佳浓度筛选(n=3)Tab1 Selection of the best concentration of LPS⁃induced macrophage RAW264.7 activity(n=3)
注:与0 组比较,##P<0.01、###P<0.001。
吸光度值1.676 7±0.002 0.694 4±0.057##0.587 3±0.062##0.497 2±0.061##0.261 6±0.015###0.039 0±0.001###525.134 0.027 LPS 浓度(μg/mL)0 0.25 0.50 1 2 4 F P
2.2 丹皮酚与TAK242 浓度筛选
为了检测丹皮酚、TAK242 对于LPS 刺激下的巨噬细胞RAW264.7 的最佳浓度筛选,分别检测了不同剂量下的丹皮酚、TAK242 预处理过的LPS 刺激 下 的 巨 噬 细 胞RAW264.7 的TLR4、NF‑κB、p‑NF‑κB 蛋 白 的 表 达。与 空 白 组 比 较,LPS 组TLR4、p‑NF‑κB 蛋白表达显著升高(P<0.01、P<0.001)。与LPS 组比较,丹皮酚在240 μmol/mL、TAK242 在10 μmol/mL TLR4、p‑NF‑κB 蛋白表达降低更显著(P<0.05、P<0.01)。见图1、2,表2。
表2 丹皮酚与TAK242 不同浓度下p⁃NF⁃κB/NF⁃κB 与TLR4 相对表达(n=3,)Tab2 Relative expressions of p⁃NF⁃κB/NF⁃κB and TLR4 at different concentrations of paeonol and TAK242(n=3)
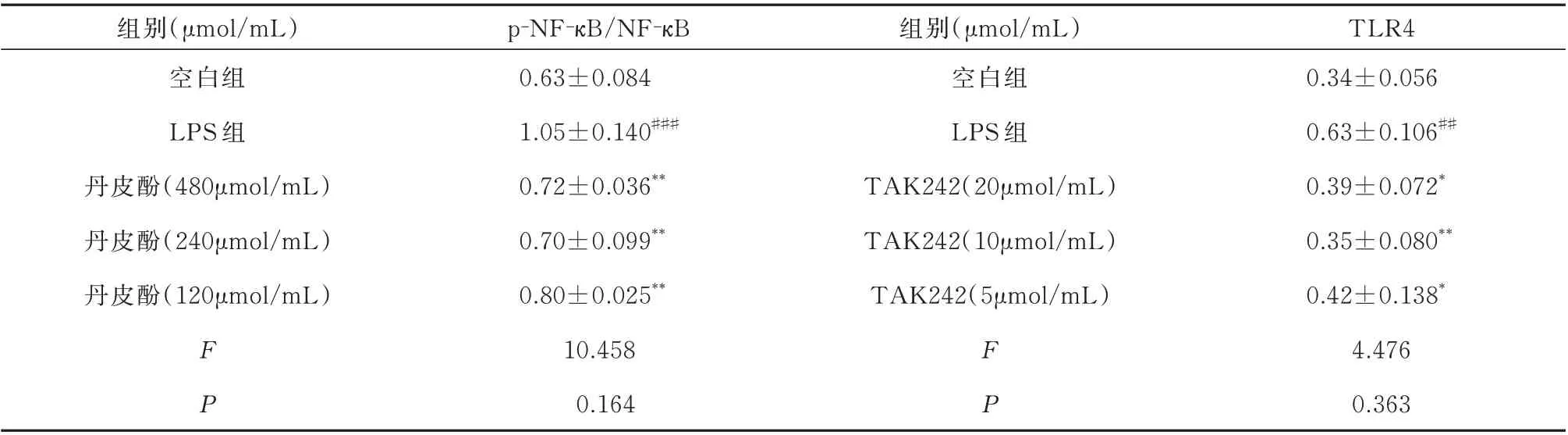
表2 丹皮酚与TAK242 不同浓度下p⁃NF⁃κB/NF⁃κB 与TLR4 相对表达(n=3,)Tab2 Relative expressions of p⁃NF⁃κB/NF⁃κB and TLR4 at different concentrations of paeonol and TAK242(n=3)
注:与空白组比较,##P<0.01、###P<0.001,与LPS 组比较,*P<0.05、**P<0.01。
TLR4 0.34±0.056 0.63±0.106##0.39±0.072*0.35±0.080**0.42±0.138*4.476 0.363组别(μmol/mL)空白组LPS 组丹皮酚(480μmol/mL)丹皮酚(240μmol/mL)丹皮酚(120μmol/mL)组别(μmol/mL)空白组LPS 组TAK242(20μmol/mL)TAK242(10μmol/mL)TAK242(5μmol/mL)F P p‑NF‑κB/NF‑κB 0.63±0.084 1.05±0.140###0.72±0.036**0.70±0.099**0.80±0.025**10.458 0.164 F P

图1 丹皮酚不同浓度下p‑NF‑κB/NF‑κB 相对表达Fig1 Relative expression of p‑NF‑κB/NF‑κB in paeonol at different concentrations

图2 TAK242 不同浓度下TLR4 相对表达Fig2 Relative expression of TLR4 at different concentra‑tions of TAK242
2.3 细胞形态学变化
通过200 倍显微镜观察,空白组细胞体积小,形态圆润;
LPS 组细胞分化严重,呈不规则形态,有形似伪足出现;
丹皮酚组细胞分化明显改善,细胞大部分恢复近圆润形态。见图3。

图3 细胞形态学变化Fig3 Morphological changes of cells
2.4 细胞培养液中GSH、MDA 含量水平
与空白组比较,LPS 组细胞培养液中GSH 含量显著降低,MDA 含量升高(P<0.01、P<0.001);
与LPS 组比较,丹皮酚组细胞培养液中GSH 含量显著增 高,MDA 含 量 降 低(P<0.01、P<0.001)。见表3。
表3 细胞培养液中GSH、MDA 含量水平(n=4,)Tab3 Content levels of GSH and MDA in cell culture medi⁃um((n=4,)

表3 细胞培养液中GSH、MDA 含量水平(n=4,)Tab3 Content levels of GSH and MDA in cell culture medi⁃um((n=4,)
注:与空白组比较,##P<0.01、###P<0.001,与LPS 组比较,**P<0.01、***P<0.001。
MDA(mmol/mg)3.23±1.05 9.34±1.25###4.52±1.83***3.87±0.75***18.935 0.522组别空白组LPS 组丹皮酚组TAK242 组F P GSH(μmol/mg)79.41±6.89 56.37±8.97##75.00±5.40**74.02±8.07**7.439 0.853
2.5 细胞线粒体膜电变化
JC‑I 为荧光探针,可快速灵敏检测细胞线粒体膜电位,在线粒体膜电位较高时产生红色荧光,线粒体膜电位较低时产生绿色荧光。通过200 倍荧光倒置显微镜观察,与空白组比较,LPS 组细胞红色荧光弱,绿色荧光强(P<0.001);
与LPS 组比较,丹皮酚组红色荧光相对变强,绿色荧光相对减弱(P<0.001)。见图4,表4。

图4 细胞线粒体膜电变化Fig4 Electrical changes of cell mitochondrial membrane
表4 细胞线粒体膜电变化红绿荧光比值(n=3,)Tab4 Ratio of red⁃green fluorescence of electrical changes in mitochondrial membrane of cells(n=3,)

表4 细胞线粒体膜电变化红绿荧光比值(n=3,)Tab4 Ratio of red⁃green fluorescence of electrical changes in mitochondrial membrane of cells(n=3,)
组别空白组LPS 组丹皮酚组TAK242 组F P红绿荧光比值1.36±0.054 0.43±0.124###1.09±0.190***1.14±0.208***23.448 0.058
2.6 免 疫 荧 光 法 检 测F4/80 及p‑NF‑κB 蛋 白 表 达分布
通过200 倍荧光倒置显微镜观察,与空白组比较,LPS 组F4/80(红色)、p‑NF‑κB(绿色)表达分布增多(P<0.001);
与LPS 组比较,丹皮酚组F4/80(红色)、p‑NF‑κB(绿色)表达分布降低(P<0.01、P<0.001)。见图5,表5。

图5 免疫荧光法检测F4/80 及p‑NF‑κB 蛋白表达分布Fig5 Expression distribution of F4/80 and p‑NF‑κB proteins detected by immunofluorescence assay
表5 免疫荧光法检测F4/80 及p⁃NF⁃κB 蛋白表达AOD 值(n=3,)Tab5 AOD values of F4/80 and p⁃NF⁃κB protein expres⁃sions detected by immunofluorescence assay(n=3,)

表5 免疫荧光法检测F4/80 及p⁃NF⁃κB 蛋白表达AOD 值(n=3,)Tab5 AOD values of F4/80 and p⁃NF⁃κB protein expres⁃sions detected by immunofluorescence assay(n=3,)
组别空白组LPS 组AOD(F4/80)3.67±0.149 5.35±0.146###AOD(p‑NF‑κB)4.8133±0.328 8.9733±0.551###丹皮酚组3.96±0.228***6.0267±0.399**TAK242 组4.06±0.243***6.2100±1.319**F P 43.284 0.569 23.448 0.055
2.7 Western blotting 检测TLR4/MAPK/NF‑κB 通路蛋白表达
与 空 白 组 比 较,LPS 组TLR4、p‑p38、p‑JNK、p‑IκB、p‑NF‑κB 蛋白表达增高(P<0.01);
与LPS 组比 较,丹 皮 酚 组TLR4、p‑p38、p‑JNK、p‑IκB、p‑NF‑κB 蛋白表达降低(P<0.05、P<0.01)。见图6,表6。

图6 Western blotting 检测TLR4/MAPK/NF‑κB 通路蛋白表达Fig6 Expression of TLR4/MAPK/NF‑κB pathway pro‑tein detected by Western blotting
表6 Western blotting 检测TLR4/MAPK/NF⁃κB 通路蛋白相对表达(n=3,)Tab6 Relative expression of TLR4/MAPK/NF⁃κB pathway protein detected by Western blotting(n=3,)
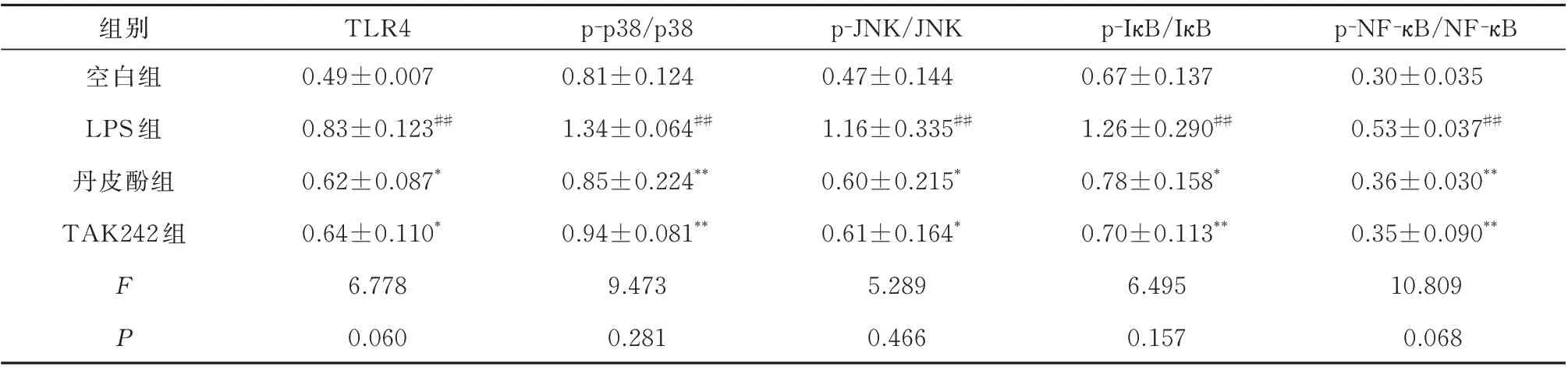
表6 Western blotting 检测TLR4/MAPK/NF⁃κB 通路蛋白相对表达(n=3,)Tab6 Relative expression of TLR4/MAPK/NF⁃κB pathway protein detected by Western blotting(n=3,)
组别空白组LPS 组丹皮酚组TAK242 组F P TLR4 0.49±0.007 0.83±0.123##0.62±0.087*0.64±0.110*6.778 0.060 p‑p38/p38 0.81±0.124 1.34±0.064##0.85±0.224**0.94±0.081**9.473 0.281 p‑JNK/JNK 0.47±0.144 1.16±0.335##0.60±0.215*0.61±0.164*5.289 0.466 p‑IκB/IκB 0.67±0.137 1.26±0.290##0.78±0.158*0.70±0.113**6.495 0.157 p‑NF‑κB/NF‑κB 0.30±0.035 0.53±0.037##0.36±0.030**0.35±0.090**10.809 0.068
中药具有功效多、多靶点、毒副作用小等优势,中药单体成分清楚,质量可控,往往起关键作用,现在,基于中药单体的新药研发,是开发具有自主知识产权新药的重要途径之一[9]。多项研究表明,丹皮酚药理学作用丰富,Li 等[10]研究发现,丹皮酚可通过NF‑κB 途径介导肝癌细胞凋亡;
Xu 等[11]研究发现,丹皮酚可改善LPS 诱导的肝细胞损伤,其机制可能与改善线粒体功能和NF‑κB 易核相关;
Guo等[12]研究表明,丹皮酚通过激活Nrf2 信号通路保护黑素细胞免受H2O2诱导的氧化应激损伤。RAW264.7 细胞在免疫应答中发挥重要功能,正常情况下,机体中的RAW264.7 细胞处于相对静止的状态,仅具有一定的趋化能力和非特异性吞噬能力。当炎性介质被RAW264.7 细胞膜表面受体识别并激活巨噬细胞,炎症开始后,大量的炎症介质被合成并释放到组织和血液中,引起细胞炎症损伤和功能絮乱[13]。LPS 是革兰阴性菌细胞壁主要成分,可被巨噬细胞膜表面受体识别诱导炎症反应[14]。LPS 诱 导 的RAW264.7 细 胞 是 体 外 研 究 炎症损伤经典细胞模型,Cheng 等[15]研究发现,柑橘提取物对LPS 诱导的RAW264.7 细胞具有抗炎作用。Han 等[3]研究发现,西咪替丁可抑制LPS 诱导的巨噬细胞RAW264.7 炎症反应,降低MAPKs 和NF‑κB 信号通路相关的因子的表达。Zhu 等[4]研究发现,大黄素可通过siRNA PPARγ 转染以降低细胞中PPARγ 的表达,从而降低细胞内NF‑κB 蛋白表达,降低LPS 诱导的巨噬细胞RAW264.7 炎症损伤。目前,对于丹皮酚干预LPS 诱导的RAW264.7细胞炎症损伤国内外鲜有报道,因此,本研究选用RAW264.7 细胞并使用LPS 刺激建立炎症模型,观察丹皮酚、TAK242 干预后细胞形态、线粒体膜电变化、GSH 水平、MDA 水平、TLR4/MAPK/NF‑κB 通路蛋白表达,同时采用TLR4 抑制剂TAK242 来验证LPS 刺激效果,并探究丹皮酚抑制炎症的分子作用机制。
GSH 是细胞中的Ⅱ项解毒酶,可清除超氧根离子、自由基及脂质过氧化产物,其水平降低提示细胞清除自由基能力下降,机体产生氧化应激损伤;
MDA 是脂质过氧化的产物,它水平变化反应了机体氧化应激受损程度;
LPS 可诱导细胞炎症损伤和氧化应激损伤,导致线粒体损伤,而线粒体在细胞代谢、自由基的生成、信号传导及控制细胞膜电位中发挥重要作用,线粒体膜电位水平,提示线粒体受损程度[16,17]。本研究结果表明,丹皮酚可增加细胞培养液中GSH 水平、降低MDA 水平,细胞中线粒体膜电位荧光增强,减轻细胞损伤。多项研究表明,LPS 可被巨噬细胞膜表面受体CD14 分子识别并结合,随之激活TLR4,通过TLR4 介导的重要的髓样分化因子88(MyD88)依赖性途径转入核内激活NF‑κB[18]。NF‑κB 在 细 胞 内 与 其 抑 制 性 蛋 白(IκB)相结合不具有转录活性,当受到上级刺激因子时,IκB 激酶(IKK)激活IκB,NF‑κB 与IκB 发生脱离转移至细胞核,与在DNA 上的κB 反应元件相结合,调节其下游靶基因,转录表达炎症因子,导致肝脏炎症损伤[19]。丝裂原活化蛋白激酶(MAPK)是NF‑κB 的上游调控因子,p38MAPK、JNK 是MAPK信号通路的重要组成部分,其在氧化应激、炎症介质等刺激下通过磷酸化而激活,激活后可增加炎症因子的释放,进一步加重细胞炎症损伤、氧化应激[20]。
免 疫 荧 光 结 果 显 示,丹 皮 酚 可 以 抑 制RAW264.7 细胞激活、p‑NF‑κB 蛋白表达分布降低;
Western blotting结果显示,丹皮酚可以抑制TLR4、p‑p38、p‑JNK、p‑IκB、p‑NF‑κB 蛋 白 表 达,降 低RAW264.7 细胞炎症损伤和氧化应激损伤。
综上所述,丹皮酚干预可改善LPS 诱导的巨噬细胞RAW264.7 炎症和氧化应激损伤,其机制与TLR4/MAPK/NF‑κB 通路蛋白表达下调相关。本研究有助于更好的理解丹皮酚保护炎症与氧化应激损伤,为丹皮酚进一步开发、应用提供了实验依据。
作者贡献度说明:
刘玉龙、颜贵明:全程参与、指导实验操作并撰写论文;
孙敏,刘玉龙,刘科:参与数据分析、荧光拍照、Western blot‑ting 实验等;
颜贵明:所有实验试剂资金支持。
所有作者声明不存在利益冲突关系。
猜你喜欢 丹皮线粒体氧化应激 线粒体自噬在纤维化疾病中作用的研究进展中华实用诊断与治疗杂志(2022年1期)2022-08-31棘皮动物线粒体基因组研究进展海洋通报(2021年1期)2021-07-23线粒体自噬与帕金森病的研究进展生物学通报(2021年4期)2021-03-16基于炎症-氧化应激角度探讨中药对新型冠状病毒肺炎的干预作用世界科学技术-中医药现代化(2020年2期)2020-07-25凤丹愈伤组织中丹皮酚含量的测定天然产物研究与开发(2018年3期)2018-05-073种丹皮酚凝胶经皮渗透性能的比较中成药(2018年1期)2018-02-02氧化应激与糖尿病视网膜病变西南军医(2016年6期)2016-01-23乙肝病毒S蛋白对人精子氧化应激的影响癌变·畸变·突变(2015年3期)2015-02-27氧化应激与结直肠癌的关系西南军医(2015年2期)2015-01-22加味桂枝茯苓汤I中丹皮酚的含量测定中医研究(2014年6期)2014-03-11 相关热词搜索:通路,诱导,损伤,






