鲈鱼抗氧化肽的稳定性分析及其对细胞氧化损伤的保护作用
时间:2023-04-09 15:05:04 来源:千叶帆 本文已影响人
高 群,黄渊楠,蔡茜茜,王一潇,杜 明,刘永乐,汪少芸,
(1.福州大学生物科学与工程学院,福建福州 350108;
2.大连工业大学食品学院,辽宁大连 116034;
3.长沙理工大学食品与生物工程学院,湖南长沙 410114)
氧化应激是一种由反应物的产生和细胞自然抗氧化能力之间的失衡引起的正常细胞和分子功能的紊乱,通常由活性氧和活性氮自由基共同导致[1]。过多的自由基造成细胞内蛋白、脂质和DNA损伤,还会诱发细胞凋亡。随着时间的推移,氧化应激可能导致一系列与衰老相关的退行性疾病,如癌症、糖尿病、黄斑变性、阿尔茨海默病和帕金森病[2]。
食品源抗氧化肽因其安全性高、低成本、高活性、易吸收等优点备受研究人员的青睐,其中动物蛋白质来源的抗氧化肽往往具有很高的营养价值,利用动物蛋白制备抗氧化肽是近年来的研究热门。Egerton等[3]水解蓝鳕鱼得到抗氧化活性肽并探究了其作为强化健康成分在饮料中的应用。吴明泽等[4]从中华圆田螺肉的酶解液中分离纯化得到的多肽在小鼠体内具有良好的抗氧化活性。抗氧化肽活性的体外评价可以分为化学评价和细胞评价,常见的化学评价方法有测定自由基清除能力、还原能力、抑制脂质过氧化能力等[5],而H2O2诱导的Caco-2和HepG2细胞损伤模型则是细胞评价的典型方法[6]。作为一种强氧化剂,H2O2能够进入细胞形成活性氧自由基并引起脂质氧化、蛋白质氧化、细胞内膜系统损伤以及DNA损伤,甚至会造成细胞凋亡。目前,通过探究肽对细胞存活率、胞内ROS产量、抗氧化酶活等的影响,来自谷物、蛋类和鱼类的多肽已被证明对H2O2诱导的细胞氧化损伤具有保护作用[7-9]。
鲈鱼(Lateolabrax maculatus),又称寨花、四肋鱼,主要分布于太平洋西岸,在我国沿海地区均有生产[10]。鲈鱼味道鲜美,又富含蛋白质、多不饱和脂肪酸和微量元素,综合营养价值高,在民间食疗方法中,常被用于产后或术后促进伤口愈合[11]。目前对鲈鱼生物活性的研究涉及促伤口愈合作用[12]、降血脂作用[13]、抗菌作用[14]、抗氧化作用[15]、抗炎及免疫调节作用[16]。
目前对鲈鱼抗氧化肽的研究多是只选用鱼肉、鱼皮或鱼鳞作为原料,本研究使用仅去除内脏的鲈鱼进行实验,减少资源如鱼骨的废弃,为鲈鱼的深度开发提供新的途径。已有的研究缺少对肽的稳定性探究,未为肽在实际生产应用中的可能提供理论依据。本研究首先通过化学实验对鲈鱼蛋白水解物(Lateolabrax maculatusprotein hydrolysates,LPH)的抗氧化活性进行评价,并进一步考察其抗氧化活性的稳定性,最后利用H2O2模拟细胞内氧化应激状态,探究LPH对Caco-2细胞氧化损伤的保护作用,以期为LPH作为功能性食品成分应用于生产提供依据。
1.1 材料与仪器
新鲜鲈鱼 福建省福州市当地市场;
Caco-2细胞系 北京北纳创联生物技术研究院;
木瓜蛋白酶(800 U/mg) 上海源叶生物科技有限公司;
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 东京化成工业株式会社;
2,2” -联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)上海麦克林生化科技有限公司;
H2O2西陇科学股份有限公司;
活性氧(Reactive oxygen species,ROS)检测试剂盒、线粒体膜电位检测试剂盒(JC-1) 上海碧云天生物技术有限公司;
乳酸脱氢酶(Lactate dehydrogenase,LDH)测定试剂盒、过氧化氢酶(Catalase,CAT)测试盒、总超氧化物歧化酶(Total superoxide dismutase,T-SOD)测试盒、总蛋白定量测试盒 南京建成生物工程研究所。
3111型CO2培养箱、Genesys 10s型紫外可见分光光度计 美国Thermo Fisher Scientific公司;
Ts2-FL型倒置荧光显微镜 日本Nikon公司;
SpectraMax iD3型多功能酶标仪 美谷分子仪器(上海)有限公司;
FE20型pH计 梅特勒-托利多仪器公司;
F-4600型荧光分光光度计 日本日立公司;
HH-4型数显恒温水浴锅 国华电器有限公司;
Super Mini Dancer型调速型迷你离心机 生工生物工程(上海)股份有限公司;
TD5B型低速离心机 长沙湘智离心机仪器有限公司;
JY92-IID型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;
MJ-BL25C3型绞肉机广东美的精品电器制造有限公司;
TH2-82型水浴恒温摇床 金坛市鸿科仪器厂;
FD-1C-50型冷冻干燥机 北京博医康实验仪器有限公司。
1.2 实验方法
1.2.1 鲈鱼蛋白酶解物的制备 通过单因素和响应面试验优化蛋白酶的种类、料液比、加酶量等条件,本论文探究前期最佳工艺条件下制备得到的多肽的抗氧化活性和稳定性。鲈鱼去除内脏后用清水洗净,将整条鱼剁碎后用绞肉机搅成肉糜,在料液比1:3.8(g/mL)、加酶量2.14%(g/g)、酶解时间0.93 h条件下用木瓜蛋白酶进行对其酶解,酶解物冻干后于-20 ℃保存备用。
1.2.2 鲈鱼抗氧化肽分子量的测定 采用高效液相色谱法测定鲈鱼抗氧化肽的分子量分布,TSK gel 2000 SWXL(7.8 i.d.×300 mm)柱,流速为0.5 mL/min,上样量为10 μL。
1.2.3 体外抗氧化能力实验
1.2.3.1 DPPH自由基清除能力的测定 根据颜阿娜等[17]的方法进行测定,配制0.1 mmol/L DPPH溶液(95%乙醇为溶剂),设置空白对照组(0.5 mL DPPH溶液与95%乙醇等量混合)、样品组(0.5 mL不同浓度样品与DPPH溶液等量混合)、样品参比组(0.5 mL不同浓度样品与95%乙醇等量混合),室温下避光静置30 min后于517 nm处测定吸光值并按下式计算:

式中:Ai:样品组吸光值;
Aj:样品参比组吸光值;
A0:空白对照组吸光值。
1.2.3.2 ABTS+自由基清除能力的测定 根据Hernandez-Ledesma等[18]描述的方法并稍作修改,配制7 mmol/L ABTS溶液和2.45 mmol/L K2S2O8溶液,等量混合后于室温下避光静置16 h得到ABTS母液。配制5 mmol/L 磷酸盐缓冲液(Phosphate buffered saline,PBS)(pH7.4)作为稀释和调零液,ABTS母液用PBS稀释至在734 nm处吸光值为0.70±0.02,加入等体积样品溶液(样品组)或去离子水(空白组),混匀并静置10 min,于734 nm处测定吸光值并按下式计算:

式中:A0:空白组吸光值;
Ai:样品组吸光值。
1.2.3.3 还原力的测定 参考张强等[19]的方法并稍作修改,配制0.2 mol/L PBS缓冲液(pH6.6)、1%K3[Fe(CN)6]溶液、10% C2HCl3O2溶液和1% FeCl3溶液。0.5 mL样品(样品组)或去离子水(空白组)与1.25 mL PBS、1.25 mL K3[Fe(CN)6]溶液混合,于50 ℃保温20 min后加入1.25 mL C2HCl3O2溶液充分混匀,3000 r/min离心10 min,取1.25 mL上清液加入1.25 mL蒸馏水和0.25 mL FeCl3溶液,室温静置10 min后于700 nm处测定吸光值。样品的还原力与吸光值成正比。
1.2.4 抗氧化活性稳定性实验
1.2.4.1 pH稳定性 参考Singh等[20]的实验,配制4 mg/mL LPH溶液,分别将其pH调至2.0、4.0、6.0、8.0、10.0、12.0,室温(25 ℃)下静置2 h后将pH调回原始pH,并测其DPPH自由基清除活性。
1.2.4.2 热稳定性 参考Alahyaribeik等[21]的实验,配制4 mg/mL LPH溶液,分别在25(室温)、40、60、80、100 ℃下保温2 h,每隔30 min取样进行DPPH自由基清除活性的测定。
1.2.4.3 金属离子稳定性 参考郭其洪等[22]的实验并稍作修改,配制4 mg/mL LPH溶液,分别向溶液中加入KCl、CaCl2、CuSO4、ZnSO4,使金属离子浓度分别达到0.25、0.5、1、2 mmol/L,室温静置2 h后测其DPPH自由基清除活性。
1.2.4.4 模拟胃肠道消化 根据刘珊珊等[23]的方法进行测定,配制4 mg/mL的LPH溶液,用0.1 mol/L HCl溶液调节pH至2.0后加入2%(g/g)的胃蛋白酶模拟胃消化,于37 ℃反应1 h,每0.5 h取样用沸水煮10 min灭酶后进行DPPH自由基清除率测定;
胃消化完成后用0.1 mol/L NaOH溶液调节pH至7.0,加入4%(g/g)的胰蛋白酶模拟肠消化,于37 ℃反应3 h,每0.5 h取样用沸水煮10 min灭酶后进行DPPH自由基清除率测定。
1.2.5 细胞内抗氧化实验
1.2.5.1 细胞培养与分组 Caco-2细胞在含有20%胎牛血清、1%青霉素-链霉素混合液和1%非必需氨基酸的DMEM培养基中于37 ℃和5% CO2环境下培养。参考李亚会等[24]的方法并稍作修改,实验分为H2O2模型组、LPH样品组和空白组。模型组经650 μmol/L H2O2作用4 h后弃上清,加入新鲜培养基再培养24 h;
样品组在650 μmol/L H2O2作用4 h后弃上清,加入新鲜培养基和终浓度为100、200、400 μg/mL的LPH溶液,接着培养24 h;
空白组的细胞正常培养,用PBS代替H2O2和LPH溶液。
1.2.5.2 细胞毒性实验 调整细胞悬液浓度至5×104个/mL,每孔100 μL接种于96孔板中,37 ℃,5% CO2细胞培养箱中培养24 h后加入80 μL/孔新鲜培养基和20 μL/孔不同浓度LPH溶液再培养24 h。采用MTT法[25]测定细胞毒性,培养完成后每孔加入20 μL MTT(5 mg/mL),培养箱中孵育4 h后取出,去除上清液,每孔加入150 μL二甲基亚砜,室温下用96孔板震荡仪振荡10 min,酶标仪于570 nm处测定其吸光值。
1.2.5.3 MTT检测H2O2诱导Caco-2细胞存活率调整细胞悬液浓度至3×104个/mL,每孔100 μL接种于96孔板中,37 ℃,5% CO2细胞培养箱中培养24 h后根据实验分组情况进行处理和培养后按照上述MTT法测定Caco-2细胞存活率。
1.2.5.4 细胞内ROS产量的检测 调整细胞悬液浓度至1×105个/mL,每孔1 mL接种于12孔板中,37 ℃,5% CO2细胞培养箱中培养24 h后根据实验分组情况进行处理和培养。培养完成后,弃上清,用PBS洗2遍,每孔加入100 μL胰酶于培养箱中消化2 min后加入1 mL培养基吹打收集细胞,2000 r/min离心3 min去上清后再用PBS洗2遍,加入200 μL 10 μmol/L DCFH-DA 37 ℃避光反应30 min,2000 r/min离心5 min后弃上清,PBS洗2遍,用500 μL PBS重悬细胞,用荧光光谱仪检测其荧光强度,激发波长为488 nm,发射波长为525 nm[26]。
1.2.5.5 荧光显微镜观测细胞中线粒体膜电位的变化 使用线粒体膜电位检测试剂盒(JC-1)对Caco-2细胞中的相对线粒体膜电位进行评估[8]。调整细胞悬液浓度至2×105个/mL,每孔2 mL接种于6孔板中,37 ℃,5% CO2细胞培养箱中培养24 h后根据实验分组情况进行处理和培养。培养完成后弃上清,细胞与JC-1在37 ℃下避光孵育20 min。孵育结束后吸除上清,洗涤液洗2遍,每孔加入2 mL细胞培养液,荧光显微镜下进行观察。
1.2.5.6 细胞培养上清中LDH水平的检测 调整细胞悬液浓度至1×105个/mL,每孔1 mL接种于12孔板中,37 ℃,5% CO2细胞培养箱中培养24 h后根据实验分组情况进行处理和培养。培养结束后收集细胞培养上清,根据试剂盒说明书操作步骤进行LDH水平的检测[27]。
1.2.5.7 细胞内SOD和CAT水平的检测 调整细胞悬液浓度至2×105个/mL,每孔2 mL接种于6孔板中,37 ℃,5% CO2细胞培养箱中培养24 h后根据实验分组情况进行处理和培养。培养结束后弃上清,PBS洗2遍,胰酶消化后再用PBS洗2遍,用500 μL PBS吹打收集细胞。用超声波细胞粉碎机对细胞进行破碎后按照试剂盒说明书操作步骤进行SOD和CAT水平的检测[28]。
1.3 数据处理
使用SPSS 26.0软件对实验数据进行统计分析,每次实验做三个平行,结果用平均值±标准差表示,P<0.05处的统计显著性通过单因素方差分析(ANOVE)和Duncan多重比较确定。
2.1 LPH的分子量分布
采用高效液相色谱法测定LPH的分子量分布,由表1可知,LPH中分子量小于3000 Da的组分占91.12%,且小于1000 Da的肽段占比高达74.92%,说明LPH以短肽为主。

表1 LPH的分子量分布Table 1 Molecular mass distribution profile of LPH
2.2 LPH的体外抗氧化活性
2.2.1 DPPH自由基清除活性 DPPH自由基清除实验常用来评价物质的体外抗氧化活性。如图1所示,随着LPH浓度的提高,DPPH自由基清除率也呈现上升趋势,且在实验浓度范围内具有良好的线性关系。在4 mg/mL的样品浓度下清除率达到81.41%,LPH对DPPH自由基清除的半数抑制浓度IC50值约为2.13 mg/mL,远小于蔡金秀等[29]酶解马面鱼皮胶原得到的抗氧化肽的IC50值(13.03 mg/mL)以及张靖[30]使用碱性蛋白酶酶解羊骨得到的抗氧化肽的IC50值(23.45 mg/mL),这可能是因为与马面鱼皮胶原肽和羊骨肽相比,LPH中小分子肽(<3000 Da)所占比例更多,研究表明小分子肽具有更强的抗氧化活性[26]。
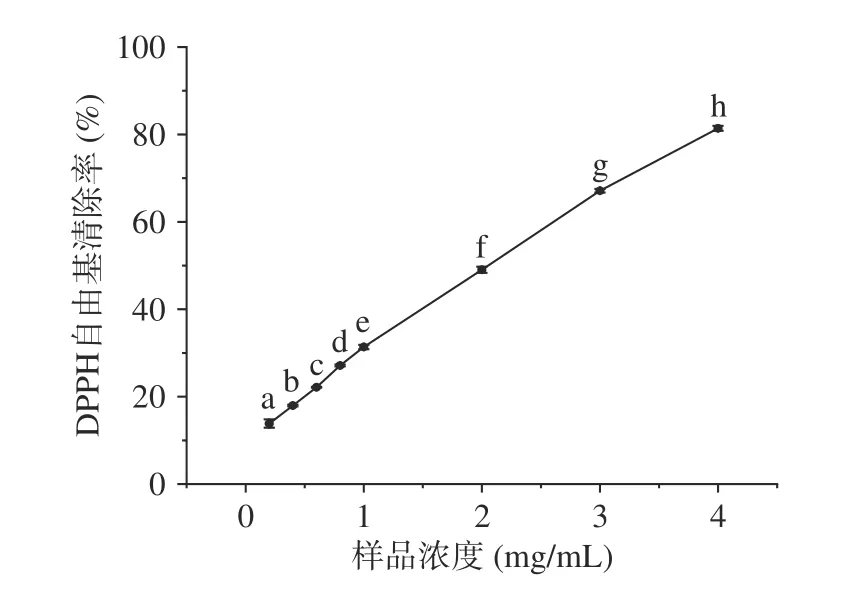
图1 LPH的DPPH自由基清除活性Fig.1 Free radical scavenging activities against DPPH of LPH
2.2.2 ABTS+自由基清除活性 ABTS+自由基清除实验因其操作简单、快速等优点被广泛应用于物质体外抗氧化活性的检测。如图2所示,LPH对ABTS+自由基具有较强的清除活性在12.5~100 μg/mL浓度范围内,ABTS+自由基清除率随浓度的增大迅速升高,达到88.85%,而当浓度继续增大到200 μg/mL时,自由基清除率为97.07%,得到LPH清除ABTS+自由基的IC50值约为31.53 μg/mL。与李军[31]研究报道的鲢鱼骨胶原多肽的IC50值(0.28 mg/mL)相比,LPH显示出更强的ABTS+自由基清除活性。范德华力和疏水作用力可增强疏水性较强的大分子与自由基之间的作用力,可能是LPH与鲢鱼骨胶原多肽中疏水性氨基酸种类及比例的差异导致了其ABTS+自由基清除活性的差异。

图2 LPH的ABTS+自由基清除活性Fig.2 ABTS+ free radical scavenging activities of LPH
2.2.3 还原力 还原力指示物质在化学反应中提供电子的能力,还原力越强的样品所表现出的抗氧化活性越强[32]。如图3所示,在实验浓度范围内,还原力大小随LPH浓度的增加而增加,这可能是由于LPH中存在电子密度较高的侧链基团和相对较高的短链肽氧化还原电位,LPH作为还原剂,通过给出电子参与自由基的清除,从而达到抗氧化的目的[26]。

图3 LPH的还原力Fig.3 Reducing power of LPH
2.3 LPH的抗氧化稳定性
2.3.1 pH稳定性 pH是影响活性肽稳定性的重要因素,食品加工过程中涉及的辅料、添加剂等物质可能会改变体系的pH,因此有必要对LPH的pH稳定性进行探究。如图4所示,pH为6.0时,LPH的DPPH自由基清除率与未经酸碱处理的对照组无显著性差异(P>0.05)。经强酸或强碱处理后,LPH的DPPH自由基清除活性稍有下降,推测可能的原因是,极端的酸碱条件使多肽发生外消旋,部分LPH肽链构象的改变抑制了其与自由基结合的能力,最终造成了LPH抗氧化活性的降低[33]。碱性条件下的不稳定可能是半胱氨酸、丝氨酸和苏氨酸被破坏的结果[34]。但是,尽管LPH的DPPH自由基清除活性受到强酸强碱环境的影响,在pH2.0和pH12.0条件下,其清除率仍为对照组的94.44%和94.33%,说明pH对LPH的DPPH自由基清除活性影响较小,利于LPH在食品加工中的应用。

图4 pH对LPH抗氧化活性的影响Fig.4 Effect of pH on antioxidant activity of LPH
2.3.2 热稳定性 温度是影响抗氧化肽活性的另一重要因素,如图5所示,随着热处理时间的延长,LPH的DPPH清除活性略有降低,但总体而言热处理对LPH的DPPH自由基清除活性影响不大,即使在100 ℃的高温处理2 h后,清除率也仅从84.99%下降至81.59%。与张靖[30]研究报道的羊骨抗氧化肽经100 ℃的高温处理2 h后DPPH清除活性降至原来的42%相比,LPH具有良好的耐热性,可能是因为LPH绝大部分是小分子肽,对温度的敏感程度较低,与完整的蛋白质结构易受高温影响变性从而导致活性降低不同,LPH中肽的结构变性较少,具有良好的抗氧化稳定性,利于其在食品热处理工艺中的应用。

图5 温度对LPH抗氧化活性的影响Fig.5 Effect of temperature on antioxidant activity of LPH
2.3.3 金属离子稳定性 在食品加工过程中,原料、水以及添加剂中含有的K+、Ca2+、Cu2+、Zn2+、Na+、Fe3+等金属离子对人体所需金属元素的补充至关重要,加之食品在加工、储藏与运输中不可避免要接触金属容器,金属离子的存在可能影响产品的品质和功效,因此本实验探究了金属离子对LPH抗氧化活性的影响。如图6所示,K+的加入对LPH的DPPH自由基清除率无显著性影响(P>0.05),而加入Ca2+和Cu2+后,随着金属离子浓度的增加,LPH的自由基清除活性也有所提升,在2 mmol/L Ca2+和Cu2+作用下,自由基清除率分别从85.30%升高至90.15%和88.38%。此外,低浓度Zn2+能够提高LPH的自由基清除率,但当浓度继续增大至1和2 mmol/L时,自由基清除率反而呈现下降趋势,这结果与张翀[35]研究报道的当Zn2+浓度为5 mmol/L时,大黄鱼抗氧化肽的DPPH自由基清除率显著低于其他离子处理组类似,这可能是由于高浓度的Zn2+能影响肽分子上的氢原子和电子转移,离子相互作用使肽的作用位点遭到屏蔽。因此LPH加工和保存过程中要尽量减少与富含Zn2+的材料接触。

图6 金属离子对LPH抗氧化活性的影响Fig.6 Effect of metal ions on antioxidant activity of LPH
2.3.4 体外胃肠道消化对LPH抗氧化活性的影响口服抗氧化肽要发挥功效势必受到消化酶的影响,包括胃蛋白酶、胰蛋白酶等。在消化酶作用下肽类物质可能会发生结构上的改变,并对其生理活性产生影响。LPH的体外模拟胃肠道消化结果如图7所示,在1 h的模拟胃液消化和3 h的模拟肠液消化过程中,肽的DPPH自由基清除活性较稳定,至消化结束时,自由基清除率与初始时无显著性差异(P>0.05)。与蔡金秀等[29]研究报道的马面鱼皮胶原抗氧化肽在经过胃液和肠液消化后抗氧化活性分别降低至初始值的89.99%和80.53%相比,LPH具有较好的胃肠道稳定性,这可能是因为LPH中的肽极少含有一些消化酶的潜在裂解位点,也可能是经消化后得到的小分子肽依然具有良好的抗氧化活性,而马面鱼皮胶原抗氧化肽中部分强活性的肽片段被水解成疏水性较低的游离氨基酸。
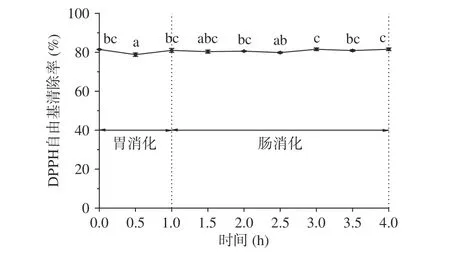
图7 模拟胃肠道消化对LPH抗氧化活性的影响Fig.7 Effect of simulated gastrointestinal digestion on antioxidant activity of LPH
2.4 LPH对H2O2诱导Caco-2细胞的抗氧化活性
体外化学实验具有操作简单、效率高等优点,但并不能真实反应LPH在生物体内的作用。因此,本研究采用H2O2诱导的Caco-2细胞氧化损伤模型对LPH的活性进行深入研究。
2.4.1 LPH对Caco-2的细胞毒性 如图8所示,在12.5~400 μL/mL的LPH作用下,Caco-2细胞存活率均大于90.0%且与空白对照组无显著性差异(P>0.05),说明在该浓度范围内,LPH对Caco-2细胞无毒性。
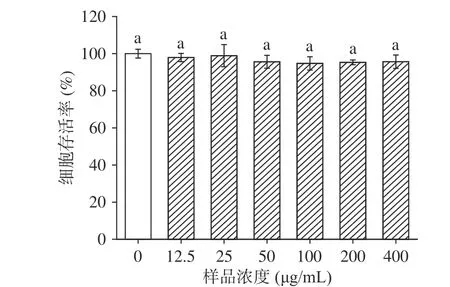
图8 LPH对Caco-2细胞的细胞毒性Fig.8 Cytotoxicity of LPH in Caco-2 cells
2.4.2 MTT测LPH对H2O2诱导Caco-2细胞活力的影响 本实验使用H2O2诱导的Caco-2细胞模型来探究LPH是否对Caco-2细胞的氧化损伤具有保护作用。如图9所示,H2O2具有较强的细胞毒性,经650 μmol/L H2O2预处理4 h的阳性对照组细胞存活率显著下降至58.02%(P<0.05),而加入LPH能呈浓度依赖性地增加细胞存活率,在400 μg/mL时细胞存活率已恢复至83.40%,说明LPH能保护细胞免受氧化损伤,显著提高细胞活力(P<0.05)。这结果与彭新颜等[9]研究报道的中、高剂量组的蓝点马鲛鱼皮抗氧化肽段能够显著提高Caco-2细胞的存活率类似,这可能是因为抗氧化肽能够清除过量的自由基,修复损伤的氧化系统并通过抑制脂质过氧化和刺激抗氧化酶活性来保护Caco-2细胞免受H2O2诱导的氧化应激。选择100、200、400 μg/mL的样品浓度进行接下来的研究。
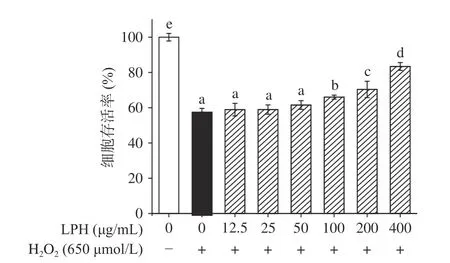
图9 LPH对H2O2诱导的Caco-2细胞活力的影响Fig.9 Effect of LPH on the cell viabilty of H2O2-induced Caco-2 cells
2.4.3 LPH对细胞内ROS产生的影响 作为能量代谢过程中产生的有毒副产物,活性氧的过量积累会对细胞造成损伤[36]。本实验通过DCFH-DA荧光探针结合荧光分光光度计来检测LPH对H2O2诱导的Caco-2细胞释放ROS的影响,结果如图10所示,空白组中的正常细胞仅产生少量的ROS,经H2O2处理后,被氧化损伤的细胞产生大量ROS,H2O2模型组中ROS的荧光强度显著增加(P<0.05),而用LPH处理能够呈浓度依赖性地降低ROS的产量,400 μg/mL样品组的ROS产量已降至模型组的51.9%。这结果与Zhang等[26]研究报道的大豆蛋白酶解物能够显著降低由H2O2引起的胞内ROS堆积类似,这可能是由于摄入LPH后,抗氧化酶如SOD、CAT的表达得到提高,ROS被及时清除,同时细胞脂质过氧化得到抑制,从而有效防止了有害的ROS流入细胞。

图10 LPH对H2O2诱导的Caco-2细胞内ROS产量的影响Fig.10 Effect of LPH on ROS generation in H2O2-induced Caco-2 cells
2.4.4 LPH对细胞线粒体膜电位的影响 线粒体是ROS的主要来源和靶点,也是氧化应激介导的膜蚀变的早期目标之一,包括通透性改变、膜电位丧失和促凋亡蛋白的释放[37]。JC-1探针是一种亲脂性阳离子染料,能够选择性地进入线粒体,随着膜电位的降低,颜色从红色变为绿色。如图11所示,在空白对照组的正常细胞中,JC-1以聚合物的形式存在,呈现明亮的红色荧光,而在阳性对照中,由于细胞被H2O2损伤,线粒体膜电位下降,JC-1为单体形式,出现大量呈现绿色荧光的细胞。但经过100、200 μg/mL LPH的处理,绿色荧光细胞的比例逐渐下降,在400 μg/mL时已恢复至正常细胞水平,在显微镜下几乎看不见呈现绿色荧光的细胞,这可能是由于LPH可以通过减少胞内ROS堆积和脂质氧化来保护线粒体膜的完整性,缓解线粒体功能障碍[8]。
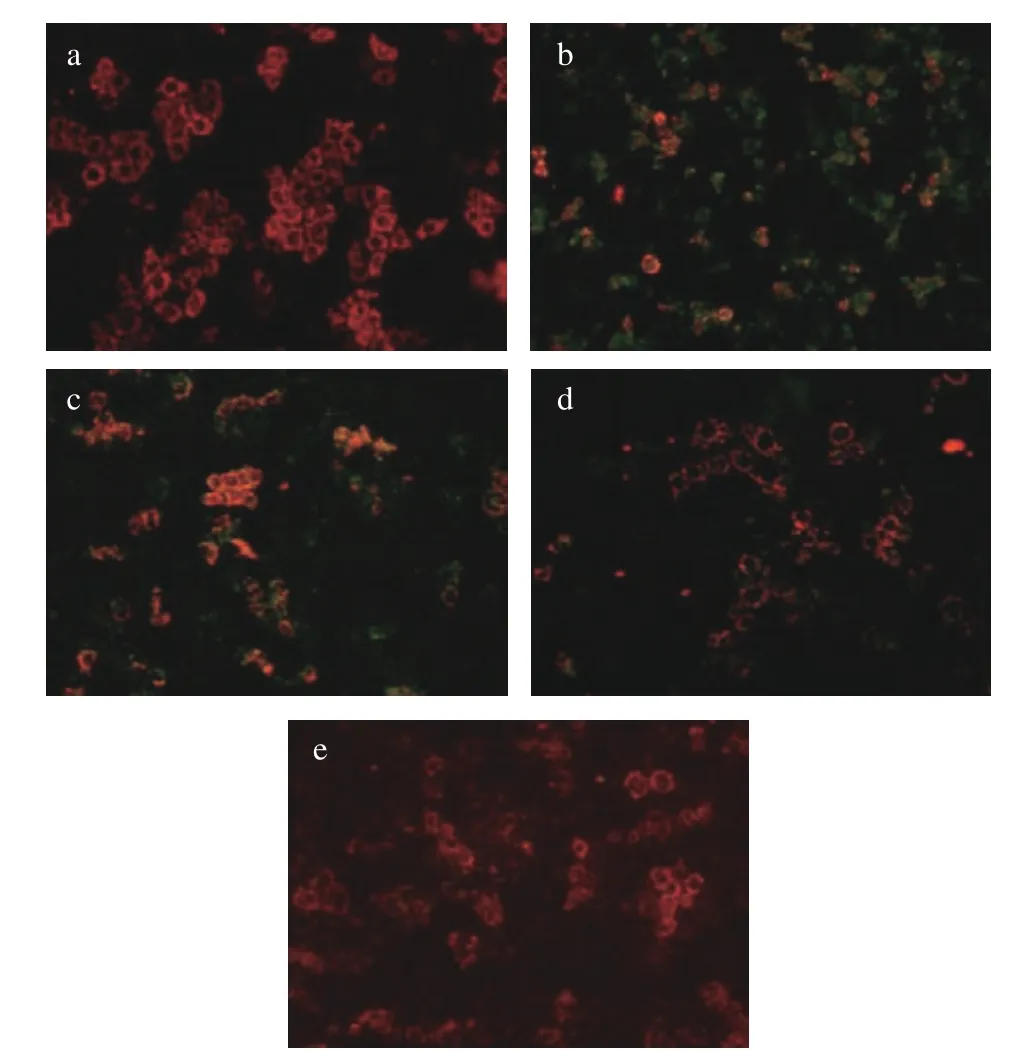
图11 LPH对H2O2诱导的Caco-2细胞线粒体膜电位的影响Fig.11 Effects of LPH on mitochondrial membrane potential of H2O2-induced Caco-2 cells
2.4.5 LPH对细胞培养上清中LDH水平的影响 细胞膜受损时,原本稳定存在于细胞质内的LDH会释放到细胞培养液中,因此,可通过检测细胞培养上清中的LDH活性来评估细胞受损程度。由图12可知,H2O2使细胞严重受损,上清中LDH活力由空白组的14.19 U/L增加至109.46 U/L,而经不同浓度LPH处理后,LDH活力呈浓度依赖性显著下降(P<0.05),当LPH浓度增加至400 μg/mL时,LDH活力已与空白组无显著性差异(P>0.05)。这可能是由于过量的自由基造成细胞膜脂质损伤,而LPH能够抑制脂质的过氧化,修复受损的细胞膜并保护细胞膜的完整性,缓解了H2O2引起的细胞氧化损伤[9]。
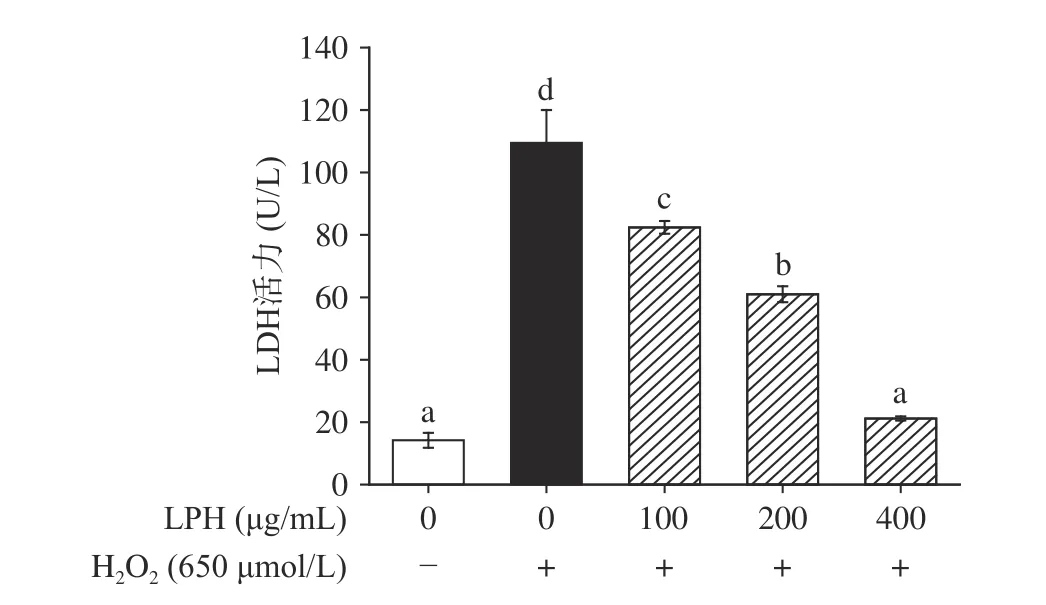
图12 LPH对H2O2诱导的Caco-2细胞上清中LDH水平的影响Fig.12 Effect of LPH on LDH activity in H2O2-induced Caco-2 cells
2.4.6 LPH对细胞内SOD活性的影响 以SOD为代表的抗氧化酶能够中和在ATP生产过程产生的ROS,对酶系统具有保护作用,常用来测定细胞氧化损伤程度[38]。如图13所示,H2O2具有强氧化性和渗透性,能够直接破坏细胞内的大分子并造成细胞器的损伤,模型组中SOD活力相比空白组显著下降(P<0.05),而LPH能够显著增加SOD活力(P<0.05),在100 μg/mL浓度下,细胞内SOD活力已经和空白组无显著性差异(P>0.05),而当肽的浓度达到200 μg/mL时,SOD活力甚至显著高于空白组水平(P<0.05)。这结果与张翀[35]研究报道的大黄鱼蛋白源抗氧化肽可显著抑制由H2O2引起的HepG2细跑内SOD活性的下降类似,表明LPH能够修复细胞抗氧化防御系统,降低自氧化速率,缓解为了清除大量自由基而产生的酶促反应造成的抗氧化酶活性下降。

图13 LPH对H2O2诱导的Caco-2细胞内SOD活性的影响Fig.13 Effect of LPH on SOD activity in H2O2-induced Caco-2 cells
2.4.7 LPH对细胞内CAT活性的影响 CAT催化H2O2分解成氧和水,从而保护细胞免受H2O2引起的氧化损伤[39]。如图14所示,H2O2处理后过量的ROS造成内源抗氧化损伤,细胞内CAT活力显著降低至空白组的71.85%(P<0.05),但经LPH作用后,CAT活力呈浓度依赖性增加,当LPH的浓度达到400 μg/mL时,CAT活力可恢复至空白组的95.40%,和空白组无显著性差异(P>0.05)。这可能是由于蛋白在细胞内主要以酶的形式存在,自由基直接攻击酶蛋白使其肽链断裂或导致侧链氨基酸残基的氧化和过氧化,蛋白功能性丧失使得CAT酶活力降低,而LPH通过清除自由基来保护CAT的活性[40]。

图14 LPH对H2O2诱导的Caco-2细胞内CAT活性的影响Fig.14 Effect of LPH on CAT activity in H2O2-induced Caco-2 cells
本实验使用木瓜蛋白酶水解仅去除内脏的鲈鱼制备抗氧化肽,体外抗氧化实验测得LPH的DPPH、ABTS+自由基清除率的IC50分别为2.13 mg/mL和31.53 μg/mL,表现出较好的抗氧化活性。进一步对其抗氧化活性的稳定性研究发现,LPH具有良好的pH和热稳定性。在0.25~2 mmol/L的浓度范围内,K+对LPH的DPPH自由基清除率没有明显影响,Ca2+和Cu2+能够增加自由基清除率,但是高浓度的Zn2+会降低LPH的DPPH自由基清除活性。在模拟胃肠道消化实验中,LPH展现出良好的抗氧化稳定性。在细胞实验中,LPH能够增加被H2O2氧化损伤的Caco-2细胞的存活率,显著减少ROS的产生(P<0.05),细胞线粒体膜电位得到恢复,因细胞膜损伤而释放到细胞培养上清中的LDH水平显著降低(P<0.05),抗氧化酶SOD和CAT的活力增强,证明了LPH在生物学功能上的抗氧化潜力,为其在食品保健领域的应用提供理论依据。
猜你喜欢清除率自由基抗氧化膀胱镜对泌尿系结石患者结石清除率和VAS评分的影响现代仪器与医疗(2022年4期)2022-10-086000倍抗氧化能力,“完爆”维C!昶科将天然虾青素研发到极致当代水产(2021年6期)2021-08-13昆明市女性宫颈高危型HPV清除率相关因素分析云南医药(2021年3期)2021-07-21自由基损伤与鱼类普发性肝病当代水产(2020年4期)2020-06-16自由基损伤与巴沙鱼黄肉症当代水产(2020年3期)2020-06-15逍遥散对抑郁大鼠的行为学及抗氧化作用的影响中成药(2019年12期)2020-01-04陆克定:掌控污染物寿命的自由基科学中国人(2018年8期)2018-07-23早期乳酸清除率对重症创伤患者的预后评估中国继续医学教育(2016年30期)2016-02-15檞皮苷及其苷元清除自由基作用的研究特产研究(2015年1期)2015-04-12猪皮胶原蛋白抗氧化肽的分离纯化及体外抗氧化活性研究食品工业科技(2014年15期)2014-03-11 相关热词搜索:鲈鱼,损伤,其对,






